
 實驗室有一瓶保管不當的試劑(如圖1),其殘缺的標簽中只剩下“Na”和“10%”字樣.已知它是無色液體,是初中化學常用的試劑.小強和小華同學很感興趣,決定對其成分進行探究:
實驗室有一瓶保管不當的試劑(如圖1),其殘缺的標簽中只剩下“Na”和“10%”字樣.已知它是無色液體,是初中化學常用的試劑.小強和小華同學很感興趣,決定對其成分進行探究:| 物質 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步驟 | 實驗現象 | 結論及化學方程式 |
| 取樣于試管中,滴加氫氧化鈣溶液 | 白色渾濁 | 猜想②正確 相關的化學方程式為Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
分析 【交流討論】根據物質的性質進行分析,含有金屬元素的物質不可能是酸;
【得出結論】根據物質的溶解度可以計算出所形成的溶液的溶質質量分數解答;【作出猜想】根據題中信息解答;
【設計并實驗】堿性溶液的pH大于7,碳酸鈉能與氫氧化鈣反應生成碳酸鈣沉淀和氫氧化鈉,據此分析解答即可.
【實驗反思】根據加入的碳酸鈉先與鹽酸反應,把鹽酸消耗完了,才開始與氯化鈣反應,開始生成沉淀,最后到達最高點說明已經反應完了進行解答.
解答 解:
【交流討論】受損標簽中含有鈉元素,酸中不含有金屬元素,故不可能是酸,故填:A;
【得出結論】根據20℃時各物質的溶解度,可以計算出其飽和溶液的溶質質量分數,
NaCl:$\frac{36g}{136g}$×100%≈24.5%;
NaOH$\frac{109g}{209g}$×100%≈52.2%;
Na2CO3:$\frac{215g}{315g}$×100%≈68.3%;
NaHCO3:$\frac{9.6g}{109.6g}$×100%≈8.8%;
標簽上的溶質質量分數是10%,故不可能是碳酸氫鈉,故填:NaHCO3;
【作出猜想】該物質可能是氫氧化鈉溶液、碳酸鈉溶液或氯化鈉溶液,故填:NaOH;
【設計并實驗】
(1)溶液的pH大于7,說明溶液呈堿性,而氯化鈉的溶液呈中性,故不可能是氯化鈉溶液,故填:NaCl;
(2)若猜想②正確,則碳酸鈉能與氫氧化鈣反應生成碳酸鈣白色沉淀,故填:有白色沉淀生成,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【實驗反思】
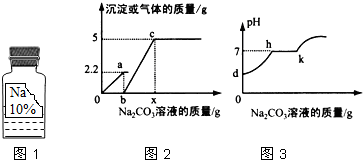
(3)由圖2可知,加入的碳酸鈉先與鹽酸反應,把鹽酸消耗完,才開始與氯化鈣反應,開始生成沉淀,故小華同學所取廢液中的溶質含CaCl2和HCl;
(4)圖1中中b→c段反應過程中是碳酸鈉溶液和氯化鈣反應,生成沉淀,溶液中性,所以圖1中b→c0段反應過程中溶液的pH變化情況可用圖2中h-k段曲線表示;
(5)根據題意可知碳酸鈉先與鹽酸反應,再與氯化鈣反應,由圖示可知碳酸鈉與鹽酸反應生成氣體2.2g,碳酸鈉與氯化鈣反應,生成沉淀5.0g.
設生成2.2g氣體所需的Na2CO3的質量為y,
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
y 2.2g
$\frac{106}{y}$=$\frac{44}{2.2g}$
解得,y=5.3g;
Na2CO3溶液的質量$\frac{5.3g}{10%}$=53g,所以圖1中b點的值為53;
生成沉淀5.0g所需Na2CO3的質量為z.則
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
z 5g
$\frac{106}{z}$=$\frac{100}{5g}$
z=5.3g
Na2CO3溶液的質量$\frac{5.3g}{10%}$=53g,
x的值為53g+53g=106g
故答案為:
【交流討論】A;
【得出結論】NaHCO3;
【作出猜想】NaOH;
【設計并實驗】
(1)NaCl;
(2)白色渾濁,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
【實驗反思】
(3)CaCl2和HCl;
(4)h-k;
(5)53,106.
點評 本題考查了破損標簽試劑的確定,完成此題,可以依據破損標簽的部分已經有關物質的性質進行.要求同學們熟練掌握有關物質的性質,以便靈活應用.


 期末集結號系列答案
期末集結號系列答案科目:初中化學 來源: 題型:選擇題
| A. | 鐵釘銹蝕實驗 | |
| B. | 用注射器探究空氣與水哪種物質易被壓縮 | |
| C. | 探究影響物質溶解性因素的實驗 | |
| D. | 氫氧化鈉溶液的酚酞試液中滴加稀鹽酸探究中和反應 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
 圖是甲、乙兩物質的溶解度曲線圖,下列說法正確的是A.
圖是甲、乙兩物質的溶解度曲線圖,下列說法正確的是A.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 物質 | X | Y | Z | W |
| 反應前的質量(g) | 2 | 1 | 16 | 16 |
| 一段時間后的質量(g) | 17 | m | 6 | 11 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 干冰能用于人工降雨 | B. | 二氧化碳用作滅火劑 | ||
| C. | 二氧化碳能用來生產碳酸飲料 | D. | 二氧化碳用作氣體肥料 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
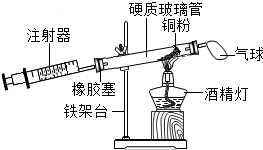
| 硬質玻璃管中空氣的體積 | 反應前注射器中的空氣體積 | 反應后注射器中的空氣體積 | 實驗測得空氣中氧氣的體積分數 |
| 32mL | 18mL | 9mL | 18% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com