
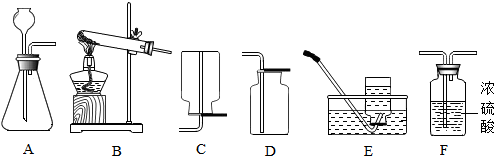
| A | B | C | D |
| 測定空氣中氧氣的含量 | 稀釋濃硫酸 | 鐵釘在空氣中的變化 | 一氧化碳還原氧化鐵 |
木炭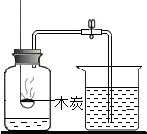 | 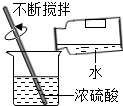 | 水 | 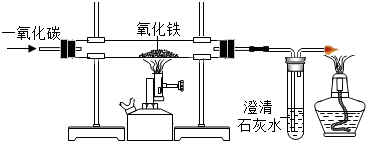 |
分析 Ⅰ、(1)根據高錳酸鉀受熱時能夠分解生成錳酸鉀、二氧化錳和氧氣進行分析;
(2)據二氧化碳的實驗室制法是用稀鹽酸與大理石(或石灰石.其主要成分都是碳酸鈣)反應來制取.其反應原理是CaCO3+2HCl=CaCl2+CO2↑+H2O.濃硫酸據有吸水性可做干燥劑;
(3)溶液稀釋前后,溶質質量不變;
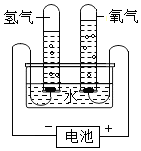
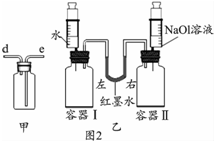
Ⅱ、(1)A、B、C、D四個實驗中:A實驗生成物為二氧化碳氣體,不能形成氣壓差,故不能達到實驗目的;而B稀釋濃硫酸,應將濃硫酸倒入水中,故不能達到實驗目的;A實驗測定空氣中氧氣的含量,故應充分消耗氧氣;
(2)B實驗稀釋濃硫酸,玻璃棒攪拌并及時散熱;C實驗鐵絲生銹消耗空氣中的氧氣,管內外形成氣壓差,故U型管中液面左高右低;
(3)D實驗一氧化碳還原氧化鐵,已知反應物一氧化碳和氧化鐵,生成物為二氧化碳和鐵,反應條件為高溫;反應完,將有尾氣一氧化碳,故需要處理掉.
解答 解:Ⅰ、(1)采用高錳酸鉀制氧氣時需要加熱,應該選用的發生裝置是B裝置,高錳酸鉀在加熱的條件下反應生成錳酸鉀、二氧化錳和氧氣,化學方程式為:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;故答案為:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;B;
(2)二氧化碳的實驗室制法是用稀鹽酸與大理石(或石灰石.其主要成分都是碳酸鈣)反應來制取.其反應原理是CaCO3+2HCl=CaCl2+CO2↑+H2O,反應為固液常溫反應,發生裝置選擇A,生成的二氧化碳通入濃硫酸干燥,再用向上排可區分收集(二氧化碳密度比空氣大,能溶于水);故答案為:CaCO3+2HCl=CaCl2+H2O+CO2↑;AFD;
(3)設需要質量分數為30%的過氧化氫溶液的體積為x,
根據稀釋前后溶質質量不變有:600g×5%=x×1.1g/cm3×30%,
x=90.9mL;
在實驗室稀釋過氧化氫溶液的主要步驟有:計算、量取、溶解、裝瓶并貼上標簽.
故答案為:90.9;量取;
Ⅱ、(1)經分析A、B、C、D四個實驗,A實驗生成物為二氧化碳氣體,不能形成氣壓差,故不能達到實驗目的;而B稀釋濃硫酸,應將濃硫酸倒入水中,故不能達到實驗目的;A實驗測定空氣中氧氣的含量,故應充分消耗氧氣;
(2)B中玻璃棒的作用是攪拌、散熱;一段時間后,C中的實驗現象為鐵絲生銹,U型管中液面左高右低;
(3)D中硬質玻璃管內發生反應的化學方程式為Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2.酒精燈的作用是點燃未反應的CO,防止其污染空氣.
答案:
(1)AB;可將裝置中的氧氣耗盡;
(2)攪拌,使產生的熱量迅速擴散(加快散熱);鐵釘生銹,U型管液面左高右低;
(3)3CO+2Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2;點燃尾氣中的CO,防止污染環境.
點評 了解金屬生銹的條件,探究測定空氣中氧氣含量的方法;掌握濃硫酸的性質和稀釋方法及其注意事項;掌握一氧化碳還原氧化鐵的實驗原理及注意事項.


 期末好成績系列答案
期末好成績系列答案 99加1領先期末特訓卷系列答案
99加1領先期末特訓卷系列答案 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:填空題
 |  |  | 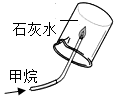 |
| ① | ② | ③ | ④ |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | N2表示2個氮原子 | |
| B. | Ca2+表示一個鈣元素帶2個單位的正電荷 | |
| C. | H2CO3中碳元素的化合價為+4價 | |
| D. | 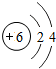 和 和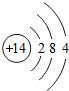 屬于同種元素 屬于同種元素 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 用天平稱量10g氯化鈉時,若指針偏右應減少砝碼 | |
| B. | 測量液體溫度時,要讓溫度計全部進入液體中 | |
| C. | 實驗剩余的藥品必須放回原瓶回收 | |
| D. | 實驗室中不能品嘗任何藥品的味道 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
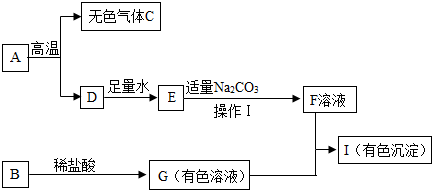
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
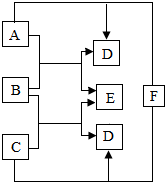 A、B、C、D、E、F都是初中化學中的常見物質,它們轉化關系如圖所示(反應條件已略去).已知:B、C為黑色固體.請回答:
A、B、C、D、E、F都是初中化學中的常見物質,它們轉化關系如圖所示(反應條件已略去).已知:B、C為黑色固體.請回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com