
分析 (1))由題意可知,濾液的總質量與生成沉淀的質量之和應等于反應前所有混合物的總質量.
(2)欲知固體混合物中CaCl2的質量,需分析題意,得出生成沉淀的質量,再根據化學方程式得出各物質之間的質量比,列出比例式,就可計算出固體混合物中氯化鈣的質量;
(3)根據上述方程式可以求出生成NaCl的質量,濾液中的溶質還包括混合物中NaCl的質量,據此可以計算出濾液中溶質的質量,然后根據溶質質量分數=$\frac{溶質質量}{溶液質量}$×100%計算即可.
解答 解:(1))由題意可知,濾液的總質量與生成沉淀的質量之和應等于反應前所有混合物的總質量.所以生成沉淀的質量=14g+96g-100g=10g;
(2)設固體混合物中氯化鈣的質量為x,生成NaCl的質量為y.
CaCl2+Na2CO3=2NaCl+CaCO3↓
111 117 100
x y 10g
$\frac{111}{x}=\frac{117}{y}=\frac{100}{10g}$
解之得:x=11.1g,y=11.7g.
(3)所得濾液即為NaCl溶液,溶液的總質量為100克,14g-11.1g是原混合物中的氯化鈉的質量,而11.7g是新生成的,所以總質量為14g-11.1g+11.7g=14.6g.
所以濾液中溶質的質量分數=$\frac{14.6g}{100g}$×100%=14.6%
答:固體混合物中CaCl2的質量是11.1g,所得濾液中溶質的質量分數是14.6%.
故答案為:
(1)10g;(2)固體混合物中氯化鈣的質量是11.1g;(3)所得濾液中溶質的質量分數是14.6%.
點評 本題主要考查學生運用化學方程式進行計算的能力.學生須認真分析題意,找出各物質間的關系,正確寫出方程式,并能根據質量分數公式計算,才能正確解答.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | H2SO4 AgNO3 NaCl | B. | CaCl2 K2CO3 NaNO3 | ||
| C. | CuSO4 NaCl KNO3 | D. | H2SO4 NaCl Na2SO4 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
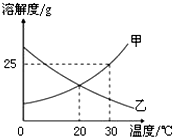 如圖是甲、乙兩種固體物質的溶解度曲線.
如圖是甲、乙兩種固體物質的溶解度曲線.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
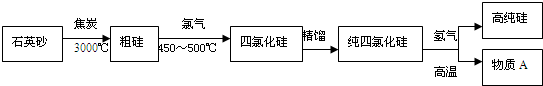
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
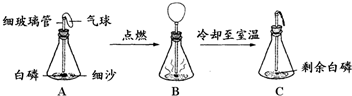
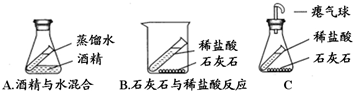
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com