
根據下列實驗裝置圖回答問題:
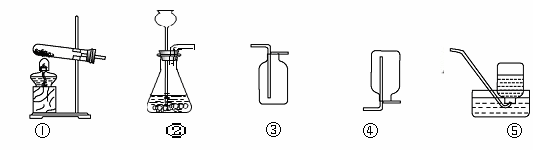
(1)實驗室用高錳酸鉀制氧氣的化學方程式為_____________________________。選用的發生裝置是 (填字母序號,下同)。
(2)實驗室制取二氧化碳時,選用的收集裝置是 。驗證二氧化碳收集滿的方法是
(寫出方法、現象、結論)
(3)實驗室收集某氣體只能用裝置④,由此說明該氣體具有的物理性質是
 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:
下表列出了一定溫度和壓強下,一定質量的活性炭所能吸附常見氣體的體積,分析表中數據與氣體組成、性質的關系,你認為下列結論正確的是( )
| 氣體 | H2 | N2 | O2 | CO2 | Cl2 |
| 氣體的沸點/℃ | -252 | -196 | -183 | -78 | -34 |
| 被吸附體積/mL | 4.5 | 11 | 35 | 97 | 494 |
A.氣體的沸點越低,越易被吸附
B.氣體分子所含原子個數越多,越易被吸附
C.氣體是化合物時,易被吸附
D.氣體的相對分子質量越大,越易被吸附
查看答案和解析>>
科目:初中化學 來源: 題型:
重金屬鹽可使人中毒,當人誤食重金屬鹽時,可以喝大量牛奶、雞蛋清或豆漿解毒。原因是上述物質中含有較多的蛋白質,蛋白質可以和重金屬鹽形成不溶于水的化合物,可以減少重金屬鹽類對胃腸粘膜的危害,起到緩解毒性的作用,為了驗證蛋白質與重金屬鹽類反應,形成難溶于水的化合物,我們可以做如下實驗:
在一支試管中加入3 mL雞蛋清溶液,再加少量的乙酸鉛溶液,然后把試管中的物質倒入盛有清水的小燒杯中觀察現象并回答問題:
(1)小燒杯中出現的現象
。
(2)為什么在農業上可以用硫酸銅配制的波爾多液來消滅害蟲?
查看答案和解析>>
科目:初中化學 來源: 題型:
(1)用圖I裝置測定空氣中氧氣的含量,證明空氣中氧氣的體積分數約為1/5, a, b兩
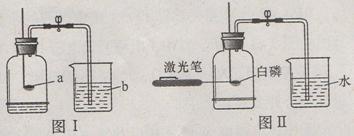 種物質可選用(填序號)。
種物質可選用(填序號)。
A.紅磷、水
B.木炭、水
C.硫、NaOH溶液
D.小蠟燭、NaCl溶液
思敏同學對該實驗進行反思后,提出了改進方法(如圖II所示),你認為改進后的優點是(任寫兩點) 。
(2)“炭火燒烤”是許多同學喜愛的食物,其原理是利用木炭燃燒的高溫來烤熟食物,炭燃燒反應的化學方程式是。冬天,在門窗緊閉的房間里吃“燒烤”,容易發生的危險是。如果在紅熱的木炭上撤一些氧化鐵紅棕色粉末,可能發生反應的化學方程式是 。
(3)冬季,園林工人在樹干上涂石灰漿以保護樹木免受蟲害。某化學興趣小組的同學
欲對工人用剩的石灰漿進行探究。
【提出猜想】石灰漿中除水之外的物質是什么?
I.只有Ca(OH)2; II.只有 ;III. 。
【實驗驗證】①要證明石灰漿中含有Ca(OH)2,可采取的操作及現象是。
②取石灰漿少量,盛裝在試管中,如果向其中加入,觀察到,則證明猜想II或III正確。
【思維拓展】工業上用石灰漿與Cl2反應制漂白粉,用來殺菌消毒。
① 配平下列化學方程式:Cl,+Ca(OH)=CaCl2+Ca(ClO)2+H,0
② 百度得知,漂白粉殺菌消毒的原理是:其中的Ca(CIO)2能與某些酸反應,生成的HCIO具有強氧化性,且不與CaCO3反應。寫出CO2通人漂白粉溶液中發生反應的化學方程
式: 。
查看答案和解析>>
科目:初中化學 來源: 題型:
為探究氣體X的組成,某興趣小組進行圖所示實驗(固定裝置未畫出)。
【資料在線】
(1)加熱條件下,氣體X能與氧化銅反應生成銅、水和氮氣。
(2)堿 石灰為固體氫氧化鈉和氧
石灰為固體氫氧化鈉和氧 化鈣的混合物,不與氣體X反應。無水氯化鈣可吸收氣體X。
化鈣的混合物,不與氣體X反應。無水氯化鈣可吸收氣體X。
(3)本實驗條件下,氮氣密度為1.15g·L-1,裝置內空氣中的水與二氧化碳對相關數據測定的影響可忽略不計。
【實驗步驟】
(1)連接儀器,并檢查裝置氣密性。
(2)取一定量氧化銅,準確稱得其質量為2.40g。
(3)按圖所示裝入藥品,測量并記錄相關數據Ⅰ(見表)。
(4)連接A、B、C裝置, 將氣體X緩緩通入一段時間后,連接上D裝置,讀數后開始加熱。當A裝置中氧化銅反應完全,停止加熱,繼續通入氣體X至玻璃管冷卻,再次測量并記錄相關數據Ⅱ(見表)。
【實驗裝置】

【相關數據】
| 測量項目 數據編號 | I | II |
| 玻璃管(含藥品)的質量/g | 52.40 | 51.92 |
| B裝置(含藥品)的質量/g | 102.00 | 102.54 |
| 氮氣的體積/mL | 243.5 |
【回答問題】
⑴B裝置中氧化鈣吸水的原理為 (用化學方程式表示)。
⑵實驗過程中,當觀察到 ,說明氧化銅已反應完全,停止加熱,繼續通入氣體X至玻璃管冷卻的目的是 。
⑶分析 實驗測量的數據,生成水的質量為 g,氧化銅中氧元素的質量為 g。由此推知,氣體X中一定 (填“有”或 “沒有”)氧元素。
實驗測量的數據,生成水的質量為 g,氧化銅中氧元素的質量為 g。由此推知,氣體X中一定 (填“有”或 “沒有”)氧元素。
⑷通過計算推導出氣體X的化學式。
查看答案和解析>>
科目:初中化學 來源: 題型:
某校學習小組準備探究氣體的測定和數據處理方法
【提出問題】
如何利用石灰石(主要成分為CaCO3)與稀鹽酸反應來測定生成的CO2的質量和體積,并處理數據。
【實驗設計】
通過下列兩個實驗分別測定CO2的質量和體積:

【分析與表達】
(1)上述兩個實驗中,反應的化學方程式是_______________________。
(2)實驗Ⅰ中,將小燒杯中的所有稀鹽酸分幾次加入到大燒杯中,并不斷攪拌,判斷石灰石中CaCO3完全反應的實驗現象是___________________________________________。
(3)實驗Ⅱ中,先連接好裝置,再_______(填操作名稱),然后裝好藥品,最后將10 mL稀鹽酸快速推入到燒瓶中,若稀鹽酸是緩慢推入的,則可能造成的后果是______。
【記錄與處理】
(4)已知實驗Ⅰ反應前的總質量[m(大燒杯+石灰石粉末)+m(小燒杯+稀硫酸)],要計算生成的CO2的質量,至少還需要的數據是_______(填序號)
A.m(小燒杯) B.m(大燒杯) C.m(大燒杯+反應后的剩余物)
(5)實驗Ⅱ的實驗記錄如下(表中數據在相同溫度、相同壓強條件下測定)
| 時間/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 注射器讀數/mL | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
①  根據以上實驗過程和數據綜合分析,最終生成CO2
根據以上實驗過程和數據綜合分析,最終生成CO2
的體積是______mL,理由是____________。
②根據你的認識,在坐標圖中繪制出0~10min生成
CO2體積隨時間變化的曲線。
【反思與評價】
(1)經過分析,你認為實驗Ⅰ的優點是________,實驗Ⅱ
的優點是________。
查看答案和解析>>
科目:初中化學 來源: 題型:
氫氧化鈣固體是登山運動員常用的能源提供劑。某探究小組的同學通過查閱資料得知,氫化鈣(CaH2)遇水反應生成氫氧化鈣和氫氣。
探究小組的同學把一定量的CaH2加入Na2CO3溶液中,充分反應后過濾,得到濾渣和濾液。經檢驗濾渣的成分是碳酸鈣。
【提出問題】濾液中溶質的成分是什么?
【猜想與暇設】猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、 Na2CO3 猜想四:NaOH、 Na2CO3、Ca(OH) 2
經過討論,大家一致認為猜想四不臺理,請用化學方程式說明原因_______________。
【實驗驗證】
| 實驗 | 現象 | 結論 |
| 實驗一:取濾液,向其中滴入少量碳酸鈉溶液 | 無明顯顯現 | 猜想__不成立 |
| 實驗二:另取濾液,向其中加入足量稀鹽酸 | ____________ | 猜想三成立 |
【反思與拓展】
①若向NH4Cl的溶液中加一定量的CaH2,充分反應,產生的氣體是____________________。
②登山運動員常用CaH2作為能源提供劑,與氫氣相比,其優點是_______________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
根據下圖回答問題

(1)寫出圖中標號①的儀器名稱___________;
(2)實驗室用鋅粒和稀硫酸制取并收集較為純凈的氫氣,所用裝置是_______________(填序號,下同),反應的化學方應方程式是_____________________________。
(3)已知銅和濃硝酸反應能制取二氧化氮氣體,二氧化氮是一種紅棕色的氣體,密度大于空氣。
①制取二氧化氮氣體選用的發生裝置是____________,向試管中裝入銅片的正確操作是______________________。
②用圖中F裝置演示分子運動的實驗時,為縮短演示時間,二氧化氮最好放在_______(填上或下)瓶的集氣瓶中,抽取兩瓶間的玻璃片,可以看到的現象是___________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
世界上每年因銹蝕而報廢的金屬設備和材料,高達產量的20%~40%.某實驗小組對鐵的燃燒和銹蝕進行如下探究。
探究一:鐵絲燃燒
 如圖1所示,取3根粗細、長度均相同的光亮細鐵絲,將其中兩根分別盤成螺旋狀,在每根鐵絲一端系上粗銅絲,另一端系一根火柴桿,點燃火柴桿待快燃盡時,分別插入充滿氧氣的集氣瓶中。觀察到:1、Ⅱ中鐵絲都劇烈燃燒,且Ⅱ中鐵絲燃燒比I中的更劇烈;Ⅲ中鐵絲沒有燃燒。
如圖1所示,取3根粗細、長度均相同的光亮細鐵絲,將其中兩根分別盤成螺旋狀,在每根鐵絲一端系上粗銅絲,另一端系一根火柴桿,點燃火柴桿待快燃盡時,分別插入充滿氧氣的集氣瓶中。觀察到:1、Ⅱ中鐵絲都劇烈燃燒,且Ⅱ中鐵絲燃燒比I中的更劇烈;Ⅲ中鐵絲沒有燃燒。

(1) 集氣瓶中加入少量水的作用:
(2) 為什么Ⅲ中鐵絲不能燃燒
(3) 分析Ⅱ中鐵絲燃燒比I中更劇烈的原因
探究二:鐵粉腐蝕的條件
如圖2所示,將包有樣品的濾紙包用大頭針固定在橡膠塞上,迅速塞緊,觀察到量筒內水沿著細導管慢慢進入廣口瓶(容積為l46ml)。當溫度恢復至室溫,量筒內水面高度不變時讀數(此廣口瓶內氧氣含量幾乎為零).記錄量筒的起始和最終讀數以及所需時間如下表:
| 序號 | 樣品 | 量筒起始讀數/ml | 量筒最終讀數/ml | 所需時間/min |
|
| 1.0g鐵粉、0.2g碳和10滴水 | 100 | 72 | 約120 |
|
| 1.0g鐵粉、0.2g碳和10滴水和少量NaCl | 100 | 72 | 約70 |
| ③ |
|
|
(4)金屬腐蝕的過程實際就是金屬元素化合價 (填升高或降低)的過程
(5)實驗①和②說明NaCl 可以 (填“加快”或“減慢”)鐵銹蝕的過程。
(6)實驗開始后,廣口瓶溫度上升說明鐵銹蝕是 (填“放熱”或“吸熱”)過程。
(7)實驗①和③是探究碳對鐵銹蝕速率的影響,實驗③表格空白處樣品的組成是 。
(8)該裝置還可能用于測量空氣中氧氣的含量。根據上述數據計算出空氣中氧氣的體積分數是 %(精確到小數點后1位),試分析該實驗結果出現誤差的原因 (寫任意一條即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com