
 化學興趣小組對“鋅與稀硫酸反應快慢的影響因素”進行了探究.
化學興趣小組對“鋅與稀硫酸反應快慢的影響因素”進行了探究.| 編號 | 硫酸的質量分數 (均取20mL) | 鋅的形狀 (均取1g) | 氫氣的體積(mL) (均收集3分鐘) |
| 1 | 20% | 鋅粒 | 31.7 |
| 2 | 20% | 鋅片 | 50.9 |
| 3 | 30% | 鋅粒 | 61.7 |
| 4 | 30% | 鋅片 | 79.9 |
| 時段 (均為1分鐘) | 第1分鐘 | 第2分鐘 | 第3分鐘 | 第4分鐘 | 第5分鐘 | 第6分鐘 |
| H2的體積/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
分析 (1)根據鋅和硫酸反應生成硫酸鋅和氫氣進行解答;
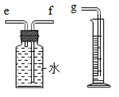
(2)為測定所收集氫氣的體積,則需要采用液體等量代換的方式,因此可以選用右圖這樣的裝置,短進長出,讓里面的水等量流到量筒內,通過量筒內液體的體積判斷收集的氣體的體積;
(3)對比四個實驗,利用控制變量法選擇合適的對比組;
(3)通過不同質量分數的硫酸或不同形狀的鋅的產生氫氣的快慢得出結論;
(4)根據表格的數據總結產生的氫氣與時間的關系并分析原因;
(5)反應物濃度、反應溫度、反應物接觸面積、有無催化劑等因素常影響化學反應速率,利用控制變量的思想設計一個因素對反應速率的影響.
解答 解:(1)鋅和硫酸反應生成硫酸鋅和氫氣,反應的化學方程式為Zn+H2SO4=ZnSO4+H2↑;
(2)因為氫氣不易溶于水,可以通過壓強的變化利用排水法把水壓入量筒內,根據進入量筒中水的體積,判斷生成氫氣的體積,故進氣管是短管e,所以正確的鏈接順序是:氫氣→e→f→g;
(3)要比較不同質量分數的硫酸對反應快慢的影響,其中的鋅的狀態保持不變,選擇不同質量分數的硫酸,看產生氫氣的快慢,因此可以選擇①③(都是鋅粒)或②④(都是鋅片);通過①③(都是鋅粒,硫酸的質量分數不同),可以看出:硫酸的質量分數越大,反應速率越快;通過①②(鋅粒和鋅片與質量分數相同的硫酸反應)可以看出:鋅與硫酸的接觸面積越大,反應速率越快;
(4)從表格可以看出反應由慢到快然后逐漸減慢;因為隨著反應的進行,反應放出熱量,反應速度加快,但隨著硫酸被消耗,硫酸溶質質量分數變小,反應速度又逐漸減慢;
(5)如設計溫度對反應快慢的影響,具體的操作為:取質量相等的鋅粒分別放入兩只試管中,然后分別加入溫度不同,體積和溶質質量分數相同的稀硫酸,測量收集等體積的氫氣所需要的時間.(只要有控制變量的意識即可);
故答案為:(1)Zn+H2SO4=ZnSO4+H2↑;(2)e f g;
(3)①③或②④;相同條件下,硫酸的質量分數越大,反應速率越快或鋅與硫酸的接觸面積越大,反應速率越快;
(4)隨著硫酸被消耗,硫酸溶質質量分數變小,所以反應速度由快變慢.
(5)溫度;溫度.
點評 本題以影響產生氫氣的反應速率為實驗探究的形式考查了反應物濃度、顆粒的大小、反應溫度等因素對化學反應速率的影響,重點在于培養學生的實驗探究能力,注意控制變量的運用.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:計算題
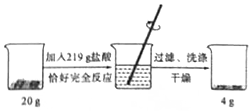 為了測定某赤鐵礦石中氧化鐵的質量分數,進行如下實驗.請根據實驗過程和提供的數據進行計算.(礦石中的雜質既不溶于水也不與鹽酸反應)
為了測定某赤鐵礦石中氧化鐵的質量分數,進行如下實驗.請根據實驗過程和提供的數據進行計算.(礦石中的雜質既不溶于水也不與鹽酸反應)查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
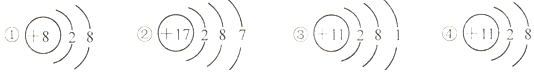
| A. | ①的化學性質比較穩定 | B. | ③④屬于同種元素 | ||
| C. | ②容易得到電子 | D. | ④是一種陰離子 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | C5H10O2 | B. | C6H6O | C. | C5H10O5 | D. | C6H12O6 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
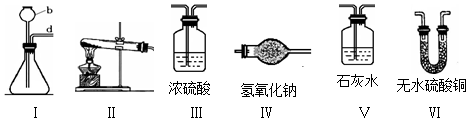
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
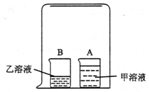 老師在課堂上演示了一個有趣的實驗:在一只潔凈的小燒杯A中裝入30ml蒸餾水,再滴入2-3滴石蕊試液(甲溶液);在小燒杯B中裝入30mL濃鹽酸(乙溶液);用一個玻璃水槽把A、B兩個燒杯罩在一起,一會兒就看到A燒杯中的溶液變成了紅色.
老師在課堂上演示了一個有趣的實驗:在一只潔凈的小燒杯A中裝入30ml蒸餾水,再滴入2-3滴石蕊試液(甲溶液);在小燒杯B中裝入30mL濃鹽酸(乙溶液);用一個玻璃水槽把A、B兩個燒杯罩在一起,一會兒就看到A燒杯中的溶液變成了紅色.| 實驗(簡述實驗內容和方法) | 觀察到的實驗現象 |
| 1、用潔凈的小燒杯取20mL水,滴入2-3滴紫色石蕊試液,觀察現象; 2、取一張濾紙,滴入紫色石蕊試液,待晾干后,放在裝上有濃鹽酸的試劑瓶上方; 3、將少量氯化氫通入含有石蕊試液的蒸餾水中 | 不變色,水不能使石蕊試液變色; 不變色,氯化氫不能使石蕊試液變色; 變色,氯化氫溶解在水中形成的鹽酸能使石蕊試液變色. |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
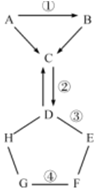 如圖表示的是初中化學常見的物質A-H相互間的關系(“→”表示物質間的轉化關系,“-”表示兩端的物質能發生化學反應).A、G都是單質,氣體C常用于滅火,D是一種可溶性鹽,F是一種藍色溶液,可用于配制農藥波爾多液.請你回答:
如圖表示的是初中化學常見的物質A-H相互間的關系(“→”表示物質間的轉化關系,“-”表示兩端的物質能發生化學反應).A、G都是單質,氣體C常用于滅火,D是一種可溶性鹽,F是一種藍色溶液,可用于配制農藥波爾多液.請你回答:查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 只有① | B. | 只有②③ | C. | 只有①③ | D. | ①②③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com