
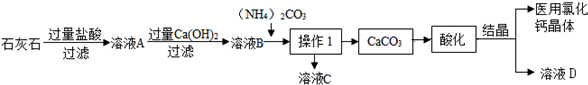
分析 (1)含有Na+、Al3+、Fe3+等雜質的碳酸鈣與鹽酸反應后得到含有Ca2+、Na+、Al3+、Fe3+、Cl-、H+等離子的溶液,調節溶液的pH為8.0~8.5,使Al3+、Fe3+沉淀而除去,.
(2)沉淀需要過濾分離,所以操作I為過濾,得到碳酸鈣后需要加入鹽酸使其轉化為氯化鈣溶液,氯化鈣溶液經過蒸發濃縮、冷卻、結晶則可得到CaCl2•2H2O晶體.過濾需要的玻璃儀器有玻璃棒、燒杯和漏斗.
(3)根據溶液C中的溶質解答即可.
(4)酸化操作是加入過量鹽酸,調節溶液的pH為4.0,根據測定溶液的酸堿度使用pH試紙解答.
解答 解:(1)含有Na+、Al3+、Fe3+等雜質的碳酸鈣與鹽酸反應后得到含有Ca2+、Na+、Al3+、Fe3+、Cl-、H+等離子的溶液,調節溶液的pH為8.0~8.5,使Al3+、Fe3+沉淀而除去;
(2)沉淀需要過濾分離,所以操作I為過濾,得到碳酸鈣后需要加入鹽酸使其轉化為氯化鈣溶液,氯化鈣溶液經過蒸發濃縮、冷卻、結晶則可得到CaCl2•2H2O晶體.過濾需要的玻璃儀器有玻璃棒、燒杯和漏斗.
(3)加入碳酸銨后,溶液中的鈣離子與碳酸根離子結合生成碳酸鈣沉淀,故加入碳酸銨所發生的反應的方程式:CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl,溶液C的一種用途作氮肥.
(4)酸化操作是加入過量鹽酸,調節溶液的pH為4.0,可以使用pH試紙測定溶液的酸堿度;
1)Fe3+;
(2)漏斗;引流;降溫結晶;
(3)用作氮肥;
(4)HCl,pH試紙.
點評 本考點屬于物質的分離和提純,考查氯化鈣晶體制備工藝流程的有關判斷,是中考的重點也是一個難點,物質的溶解性要記牢,還要加強記憶除去常用離子和特殊離子的方法,從而突破難點.根據物質的溶解性和除雜質的條件,要認真分析,綜合把握.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 用清潔能源代替化石燃料 | B. | 將生活垃圾焚燒處理 | ||
| C. | 大力發展煤炭火力發電 | D. | 多開私家車出行 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

| 物質 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
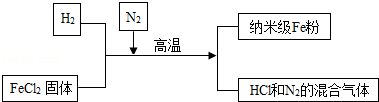
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
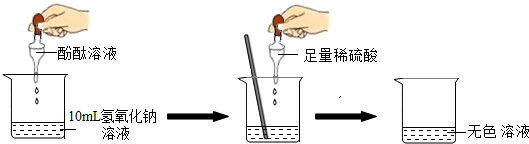
| 實驗方案 | 實驗步驟 | 實驗現象 | 實驗結論 |
| 方案一 | 取樣,滴入適量的氯化鋇溶液 | 出現白色沉淀 | 稀硫酸過量 |
| 方案二 | 取樣,滴入幾滴紫色石蕊試液 | 溶液變紅 | 稀硫酸過量 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com