
分析 (1)碳酸鈣與鹽酸反應放出二氧化碳而使反應后質量減小,利用質量守恒定律可計算放出二氧化碳的質量;
(2)根據反應的化學方程式,由放出二氧化碳的質量計算蛋殼中所含碳酸鈣的質量.
(3)根據反應的化學方程式,由放出二氧化碳的質量計算蛋殼中所含氯化鈣的質量.然后利用物質的總質量減去雜質的質量求出溶液的質量,從而求出所得溶液中溶質的質量分數.
解答 解:(1)根據質量守恒定律,生成二氧化碳的質量為80g+30g-101.2g=8.8g;故填:8.8;
(2)設30g雞蛋殼中碳酸鈣的質量為x,生成氯化鈣的質量為y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 8.8g
$\frac{100}{x}=\frac{111}{y}=\frac{44}{8.8g}$
x=20g
y=22.2g
(3)所得溶液中溶質的質量分數=$\frac{22.2g}{101.2g-(30g-20g)}$×100%≈24.3%
答:(2)30g雞蛋殼中碳酸鈣的質量為20g.(3)所得溶液中溶質的質量分數為24.3%.
點評 利用質量守恒定律求出反應放出二氧化碳的質量,是進行后面計算的基礎,體現出運用知識分析問題的能力.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:實驗探究題
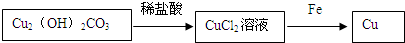 ;
;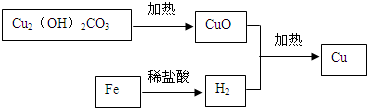 .
.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
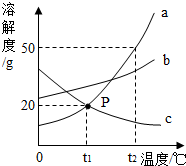 如圖是a、b、c三種物質的溶解度曲線,a與c的溶解度曲線相交于P點.據圖回答:
如圖是a、b、c三種物質的溶解度曲線,a與c的溶解度曲線相交于P點.據圖回答:查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
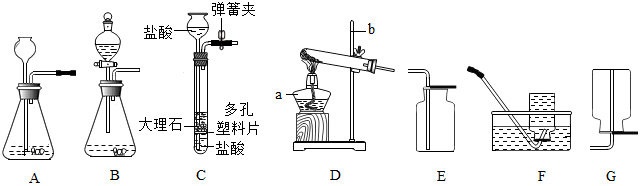
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com