礦物燃料中常含有硫元素,在燃燒過程中會產(chǎn)生污染環(huán)境的SO2氣體,該氣體可用氫氧化鈣懸濁液吸收,生成難溶于水的亞硫酸鈣(CaSO3)和水.
(1)亞硫酸鈣(CaSO3)的摩爾質(zhì)量是________,其中Ca、S、O元素的原子個數(shù)比為________;1molCaSO3中約有________個硫原子.
(2)寫出吸收SO2的化學反應方程式:________
(3)根據(jù)上述化學反應,若要吸收32g SO2氣體,理論上需要________mol Ca(OH)2.
解:(1)當物質(zhì)的質(zhì)量以克為單位時,摩爾質(zhì)量的單位為g/mol,在數(shù)值上等于該物質(zhì)的相對原子質(zhì)量或相對分子質(zhì)量,所以亞硫酸鈣(CaSO
3)的摩爾質(zhì)量為:40+32+16×3=120g/mol;
根據(jù)標在元素符號右下角的數(shù)字表示一個分子中所含原子的個數(shù);因此CaSO
3中Ca、S、O元素的原子個數(shù)比為:1:1:3;1molCaSO
3中約有 6.02×10
23 個硫原子.
故答案為:120g/mol; 1:1:3; 6.02×10
23;
(2)氫氧化鈣懸濁液吸收SO
2的化學反應方程式為:SO
2+Ca(OH)
2=CaSO
3+H
2O 或 SO
2+Ca(OH)
2=CaSO
3↓+H
2O;
故答案為:SO
2+Ca(OH)
2=CaSO
3+H
2O 或 SO
2+Ca(OH)
2=CaSO
3↓+H
2O;
(3)先計算32g SO
2為:
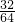
=0.5摩爾,
SO
2+Ca(OH)
2=CaSO
3↓+H
2O
1 1
0.5 X
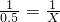
則 X=0.5 mol
故答案為:0.5 mol.
分析:(1)根據(jù)單位物質(zhì)的量的物質(zhì)所具有的質(zhì)量,稱為摩爾質(zhì)量,用符號M表示.當物質(zhì)的質(zhì)量以克為單位時,摩爾質(zhì)量的單位為g/mol,在數(shù)值上等于該物質(zhì)的相對原子質(zhì)量或相對分子質(zhì)量,進行解答;
根據(jù)標在元素符號右下角的數(shù)字表示一個分子中所含原子的個數(shù);進行解答;
科學上把含有6.02×10^23個微粒的集體作為一個單位,叫摩爾;
(2)根據(jù)反應物與生成物和化學方程式的寫配注等,寫出反應化學方程式即可;
(3)先計算32g SO
2為多少摩爾,根據(jù)方程式計算即可解答.
點評:本題考查了化學方程式的書寫及摩爾質(zhì)量的有關(guān)知識.

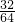 =0.5摩爾,
=0.5摩爾,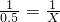 則 X=0.5 mol
則 X=0.5 mol
