
| 物質的質量 | |
| 反應前:燒杯+鹽酸 | 22g |
| 10片鈣片 | 8g |
| 反應后:燒杯+剩余物 | 27.8g |
分析 (1)根據實驗的得到二氧化碳的質量和質量守恒定律,然后根據碳酸鈣與鹽酸反應的化學方程式即可計算出參與反應的碳酸鈣的質量(即10片鈣片的質量),進而計算出每片此鈣片含碳酸鈣的質量;
(2)再根據碳酸鈣(CaCO3)中鈣元素的質量分數求出鈣元素的質量,與標簽中的含鈣量比較,即可解答.
解答 解:根據質量守恒定律,減少的質量為二氧化碳的質量,由表中信息可知:二氧化碳的質量=22g+8g-27.6g=2.2g
設含碳酸鈣的質量為x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}=\frac{44}{2.2g}$
x=5g
(1)每片此鈣片含碳酸鈣的質量=$\frac{5g}{8g}$×100%=0.4g
(2)每片此鈣片的含鈣量=0.4g×$\frac{40}{100}$×100%=0.16g,每片鈣片中鈣元素的質量分數=$\frac{0.16g}{0.4g}×$100%=40%
答案:
(1)每片此鈣片含碳酸鈣的質量0.4g
(2)每片此鈣片的含鈣元素的質量分數40%.
點評 將質量分數的計算與生活實際相聯系;計算時要理清各個量之間的關系,再結合題意進行分析解答.


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:初中化學 來源: 題型:解答題
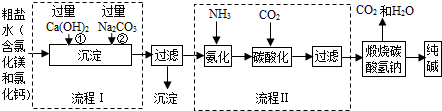
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
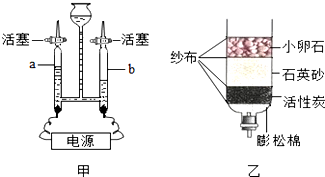
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 實驗一 | 實驗二 | 實驗三 | |
實驗 方案 | 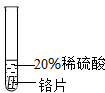 | 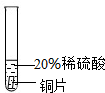 | 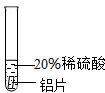 |
| 實驗 現象 | 鉻片表面產生氣泡緩慢,溶液變藍色. | 無現象 | 鋁片表面產生氣泡較快. |
| 結論 | 鉻能和稀硫酸發生反應,反應速率較慢. | 銅不與稀硫酸反應 | 鋁能與稀硫酸發生反應,反應速率較快[ |
| 三種金屬在金屬活動性順序中的相對位置關系是Al、Cr、Cu | |||
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 紅棗包裝中常使用一種袋裝防腐劑,品名為“504雙吸劑”,其標簽如下圖所示.同學們對一包久置的“504雙吸劑”固體樣品很好奇,
紅棗包裝中常使用一種袋裝防腐劑,品名為“504雙吸劑”,其標簽如下圖所示.同學們對一包久置的“504雙吸劑”固體樣品很好奇,| 實驗操作 | 實驗現象 | 實驗結論 |
| (1)取少量固體放于試管中,加足量蒸餾水溶解,靜置后取上層清液滴加無色酚酞溶液 | 固體溶解時試管外壁發燙,試管底部有不溶物,溶液變紅. | 固體中一定含有 CaO和氫氧化鈣 |
| (2)另取少量固體放于試管中,滴加足量的稀鹽酸. | 固體逐漸消失,有大量無色氣體產生,得到淺綠色溶液. | 固體中一定含有Fe, 一定不含Fe2O3 |
| (3)將步驟(2)中產生的氣體通入到澄清的石灰水中 | 澄清的石灰水變渾濁 | 固體中一定含有CaCO3 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com