解:
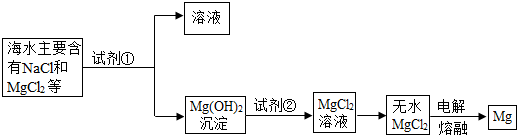
(1)氯化鎂轉化為氫氧化鎂需要加入堿液以提供氫氧根,此處選擇氫氧化鈉進行反應,加入試劑要過量,要想檢驗堿液是否過量關鍵是看反應后溶液是否顯堿性,用酚酞作指示劑檢驗,如果酚酞變紅則堿液過量.
(2)由于氫氧化鎂是沉淀,所以是分離固體與液體的過程,一般采用過濾的方式進行分離.
(3)把氫氧化鎂轉化成氯化鎂需加入鹽酸進行中和反應.
故答案為:,Mg(OH)
2+2HCl=MgCl
2+2H
2O;
(4)由題中可知反應產物,再結合化學反應方程式的書寫原則書寫方程式:MgCl
2
Mg+Cl
2↑.
故答案為:
(1)NaOH,過量,向溶液中加酚酞,若變為紅色則說明MgCl
2已完全轉變為Mg(OH)
2;
(2)過濾;
(3)鹽酸;
(4)MgCl
2
Mg+Cl
2↑.
分析:(1)氯化鎂轉化為氫氧化鎂需要加入堿液,要想檢驗堿液是否過量關鍵是看溶液是否顯堿性,用酚酞作指示劑檢驗即可.
(2)分離固體與液體一般采用過濾的方式進行分離.
(3)氫氧化鎂轉化成氯化鎂一般是采用鹽酸進行中和反應.
(4)利用題目所給的信息結合書寫化學方程式的原則進行書寫.
點評:此題是對海水中物質的提純應用的考查,主要是利用了酸堿鹽之間的相關反應,解決了物質的相關轉化,是復分解反應發生條件的具體應用.

 Mg+Cl2↑.
Mg+Cl2↑. Mg+Cl2↑.
Mg+Cl2↑.





