
36.(09年山東理綜·31)(8分)(化學-化學與技術)
金屬鋁的生產是以Al2O,為原料,在熔融狀態下進行電解:2Al2O3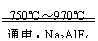
 4Al+3O2↑
4Al+3O2↑
請回答下列問題:
(1)冰晶石(Na3AIF6)的作用是 。
(2)電解生成的金屬鋁是在熔融液的 (填“上層”或“下層”)。
(3)陰極和陽極均由 材料做成;電解時不斷消耗的電極是 (填“陽極”或“陰極”)。
(4)鋁是高耗能產品,廢舊鋁材的回收利用十分重要。在工業上,最能體現節能減排思想的是將回收鋁做成 (填代號)。
a.冰晶石 b.氧化鋁 c.鋁錠 d.硫酸鋁
答案:(1)降低Al2O3的熔化溫度 (2)下層(3)碳素(或石墨) 陽極(4)c
 解析:Al2O3的熔點很高,熔化得需要較多能量,加入助熔劑就可節約能量,降低熔化溫度
解析:Al2O3的熔點很高,熔化得需要較多能量,加入助熔劑就可節約能量,降低熔化溫度
 (2)由于冰晶石(Na3AlF6)與氧化鋁熔融物密度比鋁的小,所以鋁在熔融液的下層。
(2)由于冰晶石(Na3AlF6)與氧化鋁熔融物密度比鋁的小,所以鋁在熔融液的下層。
 (3)電解時陽極的碳棒被生成的氧氣氧化。
(3)電解時陽極的碳棒被生成的氧氣氧化。
 (4)電解產生的鋁要盡量以單質形式存在,所以將回收鋁做成鋁錠最好。
(4)電解產生的鋁要盡量以單質形式存在,所以將回收鋁做成鋁錠最好。
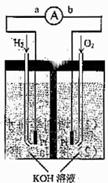
37 .(09年天津理綜·10)(14分)氫氧燃料電池是符合綠色化學理念的新型發電裝置。下圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:
.(09年天津理綜·10)(14分)氫氧燃料電池是符合綠色化學理念的新型發電裝置。下圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:
 (1)氫氧燃料電池的能量轉化主要形式是 ,在導線中電子流動方向為
(用a、b表示)。
(1)氫氧燃料電池的能量轉化主要形式是 ,在導線中電子流動方向為
(用a、b表示)。
 (2)負極反應式為
。
(2)負極反應式為
。
 (3)電極表面鍍鉑粉的原因為
。
(3)電極表面鍍鉑粉的原因為
。
 (4)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能。因此,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
(4)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能。因此,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
 Ⅰ.2Li+H2
Ⅰ.2Li+H2
 2LIH
2LIH
 Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
 ①反應Ⅰ中的還原劑是
,反應Ⅱ中的氧化劑是
。
①反應Ⅰ中的還原劑是
,反應Ⅱ中的氧化劑是
。
 ②已知LiH固體密度為0.82g/cm3。用鋰吸收224L(標準狀況)H2,生成的LiH體積與被吸收的H2體積比為
。
②已知LiH固體密度為0.82g/cm3。用鋰吸收224L(標準狀況)H2,生成的LiH體積與被吸收的H2體積比為
。
 ③由②生成的LiH與H2O作用,放出的H2用作電池燃料,若能量轉化率為80%,則導線中通過電子的物質的量為
mol。
③由②生成的LiH與H2O作用,放出的H2用作電池燃料,若能量轉化率為80%,則導線中通過電子的物質的量為
mol。
答案:(1)由化學能轉化為電能 由a到b
(2)2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
(3)增大電極單位面積吸附H2、O2分子數,加快電極反應速率
(4)①Li H2O ②或8.71×10-4 ③32
解析:本題考查電化學知識。(1)原電池的實質為化學能轉化成電能。總反應為2H2 + O2 =2H2O,其中H2從零價升至+1價,失去電子,即電子從a流向b。(2)負極為失去電子的一極,即H2失電子生成H+,由于溶液是堿性的,故電極反應式左右應各加上OH-。(3)鉑粉的接觸面積大,可以加快反應速率。(4)I.Li從零價升至+1價,作還原劑。II.H2O的H從+1降至H2中的零價,作氧化劑。由反應I,當吸收10molH2時,則生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)= 192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,實際參加反應的H2為20×80%=1.6mol,1molH2轉化成1molH2O,轉移2mol電子,所以1.6molH2可轉移3.2mol的電子。
35.(09年山東理綜·29)(12分)Zn-MnO2干電池應用廣泛,其電解質溶液是ZnCl2-NH4Cl混合溶液。
(1)該電池的負極材料是 。電池工作時,電子流向 (填“正極”或“負極”)。
(2)若ZnCl2-NH4Cl混合溶液中含有雜質Cu2+,會加速某電極的腐蝕,其主要原因是
。欲除去Cu2+,最好選用下列試劑中的 (填代號)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生產方法之一是以石墨為電極,電解酸化的MnSO4溶液。陰極的電極反應式是 。若電解電路中通過2mol電子,MnO2的理論產量為 。
答案:(1)Zn(或鋅) 正極
(2)Zn與Cu2+反應生成Cu,Zn與Cu構成原電池,加快反應速率 b
(3)2H++2e-=H2↑ 87g
 解析:(1) 負極上是失電子的一極 Zn失電子有負極經外電路流向正極。(2)鋅與還原出來的Cu構成銅鋅原電池而加快鋅的腐蝕。除雜的基本要求是不能引入新雜質,所以應選Zn將Cu2+
置換為單質而除去。(3)陰極上得電子,發生還原反應, H+得電子生成氫氣。因為MnSO4-MnO2-2 e-,通過2mol電子產生1molMnO2,質量為87g。
解析:(1) 負極上是失電子的一極 Zn失電子有負極經外電路流向正極。(2)鋅與還原出來的Cu構成銅鋅原電池而加快鋅的腐蝕。除雜的基本要求是不能引入新雜質,所以應選Zn將Cu2+
置換為單質而除去。(3)陰極上得電子,發生還原反應, H+得電子生成氫氣。因為MnSO4-MnO2-2 e-,通過2mol電子產生1molMnO2,質量為87g。
 [考點分析] 原電池原理和電解原理綜合運用
[考點分析] 原電池原理和電解原理綜合運用
34.(09年寧夏理綜·37)[化學-選修化學與技術](15分)
請回答氯堿的如下問題:
(1)氯氣、燒堿是電解食鹽水時按照固定的比率k(質量比)生成的產品。理論上k= (要求計算表達式和結果);
(2)原料粗鹽中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等雜質,必須精制后才能供電解使用。精制時,粗鹽溶于水過濾后,還要加入的試劑分別為①Na2CO3、②HCl(鹽酸)③BaCl2,這3種試劑添加的合理順序是 (填序號)
(3)氯堿工業是高耗能產業,一種將電解池與燃料電池相組合的新工藝可以節(電)能30%以上。在這種工藝設計中,相關物料的傳輸與轉化關系如下圖所示,其中的電極未標出,所用的離子膜都只允許陽離子通過。
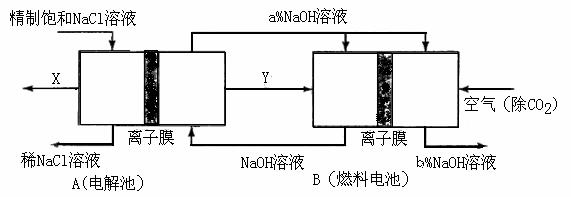 ①圖中X、Y分別是
、
(填化學式),分析比較圖示中氫氧化鈉質量分數a%與b%的大小 ;
①圖中X、Y分別是
、
(填化學式),分析比較圖示中氫氧化鈉質量分數a%與b%的大小 ;
②分別寫出燃料電池B中正極、負極上發生的電極反應正極: ; 負極: ;
③這樣設計的主要節(電)能之處在于(寫出2處) 、 。
答案:(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2)③①② (3)①Cl2 H2 a%小于b% ②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O ③燃料電池可以補充電解池消耗的電能;提高產出堿液的濃度;降低能耗(其他合理答案也給分)
解析:(1)只要了解電解飽和食鹽水的化學方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;(2)只要抓住除鋇離子要放在除碳酸根離子前即可得到順序關系:③①②;(3)本題突破口在于B燃料電池這邊,通空氣一邊為正極(還原反應),那么左邊必然通H2,這樣Y即為H2 ;再轉到左邊依據電解飽和食鹽水的化學方程式可知唯一未知的就是X,必然為Cl2了;A中的NaOH進入燃料電池正極再出來,依據O2+4e-+2H2O=4OH- 可知NaOH+濃度增大。
2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;(2)只要抓住除鋇離子要放在除碳酸根離子前即可得到順序關系:③①②;(3)本題突破口在于B燃料電池這邊,通空氣一邊為正極(還原反應),那么左邊必然通H2,這樣Y即為H2 ;再轉到左邊依據電解飽和食鹽水的化學方程式可知唯一未知的就是X,必然為Cl2了;A中的NaOH進入燃料電池正極再出來,依據O2+4e-+2H2O=4OH- 可知NaOH+濃度增大。
[點評]本題前半部基本就是課本內容的再現,但后半部很有創意,可以很好的綜合考查考生的原電池和電解的相關知識
33.
 (09年江蘇化學·16)(8分)以氯化鉀和鈦白廠的副產品硫酸亞鐵為原料生產硫酸鉀、過二硫酸鈉和氧化鐵紅顏料,原料的綜合利用率較高。其主要流程如下:
(09年江蘇化學·16)(8分)以氯化鉀和鈦白廠的副產品硫酸亞鐵為原料生產硫酸鉀、過二硫酸鈉和氧化鐵紅顏料,原料的綜合利用率較高。其主要流程如下:

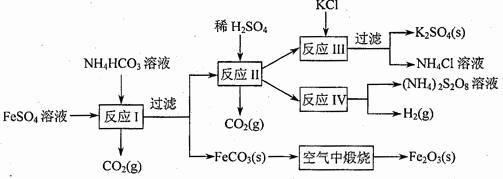
 (1)反應I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
(1)反應I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
 A.鋅粉 B.鐵屑 C.KI溶液 D.H2
A.鋅粉 B.鐵屑 C.KI溶液 D.H2
 (2)反應Ⅰ需控制反應溫度低于35℃,其目的是
。
(2)反應Ⅰ需控制反應溫度低于35℃,其目的是
。
 (3)工業生產上常在反應Ⅲ的過程中加入一定量的醇類溶劑,其目的是
。
(3)工業生產上常在反應Ⅲ的過程中加入一定量的醇類溶劑,其目的是
。
 (4)反應Ⅳ常被用于電解生產(NH4)2S2O8(二硫酸銨)。電解時均用惰性電極,陽極發生地電極反應可表示為
。
(4)反應Ⅳ常被用于電解生產(NH4)2S2O8(二硫酸銨)。電解時均用惰性電極,陽極發生地電極反應可表示為
。
 答案:(1)B
答案:(1)B
 (2)防止NH4HCO3分解(或減少Fe2+的水解)
(2)防止NH4HCO3分解(或減少Fe2+的水解)
 (3)降低K2SO4
的溶解度,有利于K2SO4 析出。
(3)降低K2SO4
的溶解度,有利于K2SO4 析出。
 (4)2SO42-
-2e-
(4)2SO42-
-2e- 2S2O82-
2S2O82-
 解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好選用鐵屑或鐵粉,比較簡單。(2)如果溫度過高會導致NH4HCO3分解同樣也會加快Fe2+的水解(溫度越高水解速率越快)這樣會使原料利用率降低。(3)由題目看出在III反應中生成的K2SO4
為固體,而K2SO4在無機溶劑中溶解度是比較大的,要想使K2SO4析出只能降低其溶解度所以加入醇類溶劑目的降低K2SO4的溶解度。
解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好選用鐵屑或鐵粉,比較簡單。(2)如果溫度過高會導致NH4HCO3分解同樣也會加快Fe2+的水解(溫度越高水解速率越快)這樣會使原料利用率降低。(3)由題目看出在III反應中生成的K2SO4
為固體,而K2SO4在無機溶劑中溶解度是比較大的,要想使K2SO4析出只能降低其溶解度所以加入醇類溶劑目的降低K2SO4的溶解度。
 (4)根據陰陽極反應原理陽極失電子發生氧化反應,此題實質是電解硫酸銨溶液,在根據反應后的產物得出正確的答案。
(4)根據陰陽極反應原理陽極失電子發生氧化反應,此題實質是電解硫酸銨溶液,在根據反應后的產物得出正確的答案。
 [考點分析]此題為化工生產題型,主要考察了化合物性質,電極方程式書寫。做此類題要分析清楚每一個環節目的和結果是什么。這樣才能判斷各反應后的產物分別是什么。
[考點分析]此題為化工生產題型,主要考察了化合物性質,電極方程式書寫。做此類題要分析清楚每一個環節目的和結果是什么。這樣才能判斷各反應后的產物分別是什么。
32. (09年海南化學·15)(9分)
(09年海南化學·15)(9分)
 Li-SOCl2電池可用于心臟起搏器。該電池的電極材料分別為鋰和碳,電解液是LiAlCl4-SOCl2。電池的總反應可表示為:4Li+2SOCl2 =4LiCl+S
+SO2。
Li-SOCl2電池可用于心臟起搏器。該電池的電極材料分別為鋰和碳,電解液是LiAlCl4-SOCl2。電池的總反應可表示為:4Li+2SOCl2 =4LiCl+S
+SO2。
 請回答下列問題:
請回答下列問題:
 (1)電池的負極材料為
,發生的電極反應為
;
(1)電池的負極材料為
,發生的電極反應為
;
 (2)電池正極發生的電極反應為
;
(2)電池正極發生的電極反應為
;
 (3)SOCl2易揮發,實驗室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,實驗現象是
,反應的化學方程式為
;
(3)SOCl2易揮發,實驗室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,實驗現象是
,反應的化學方程式為
;
 (4)組裝該電池必須在無水、無氧的條件下進行,原因是
。
(4)組裝該電池必須在無水、無氧的條件下進行,原因是
。
答案::(9分)


 (1)鋰 Li-2e-=Li+(2分)
(1)鋰 Li-2e-=Li+(2分)
 (2)2SOCl2+4e-=4Cl-+S+SO2(2分)
(2)2SOCl2+4e-=4Cl-+S+SO2(2分)
 (3)出現白霧,有刺激性氣體生成 SOCl2+H2O=SO2↑+2HCl↑(3分)
(3)出現白霧,有刺激性氣體生成 SOCl2+H2O=SO2↑+2HCl↑(3分)
 (4)鋰是活潑金屬,易與H2O、O2反應;SOCl2也可與水反應(2分)
(4)鋰是活潑金屬,易與H2O、O2反應;SOCl2也可與水反應(2分)
解析:分析反應的化合價變化,可得Li為還原劑 ,SOCl2為氧化劑。
(1)負極材料為Li(還原劑),Li – e- = Li+
(2)負極反應式可由總反應減去負極反應式得到:2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)題中給出有堿液吸收時的產物,則沒有堿液吸收時的產物應為SO2和HCl,所以現象應該為出現白霧和有刺激性氣體生成。
(4)因為構成電池的兩個主要成份Li能和氧氣水反應,且SOCl2也與水反應
30.答案:
(1)①BaCl2、NaOH、Na2CO3(錯選或多選本小題不得分。NaOH溶液的加入順序及是否答Na0H不影響得分)
②75%乙醇
(2)天平、燒杯、500 mL容量瓶、膠頭滴管
(3)< 電解生成的氯氣與電解生成的NaOH發生了反應 酸堿中和滴定
(4)c d
解析:(1)①要除去SO42-,只有選BaCl2溶液,若選用Ba(NO3)2,會引入新的離子NO3-,再選用NaOH溶液除去Mg2+和Fe3+溶液,最后選用Na2CO3溶液除去Ca2+,此處不能選用K2CO3溶液,否則會引入新的K+,再用HCl除去過量的CO32-。Na2CO3溶液不能加在BaCl2溶液前,否則會引入Ba2+。②除去NaCl晶體表面的少量的KCl,應選用75%的乙醇,因為CCl4有毒,同時KCl也不會溶解在CCl4中。
(3)2NaCl+2H2O 2NaOH+Cl2↑+H2↑,在陰級區內產生的Cl2能與該區生成的NaOH反應NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同樣條件下收集到的Cl2小于2L。
2NaOH+Cl2↑+H2↑,在陰級區內產生的Cl2能與該區生成的NaOH反應NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同樣條件下收集到的Cl2小于2L。
31.(16分)(08年山東理綜·30)食鹽是日常生活的必需品,也是重要的化工原料。
(1)粗食鹽常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等雜質離子,實驗室提純NaCl的流程如下:
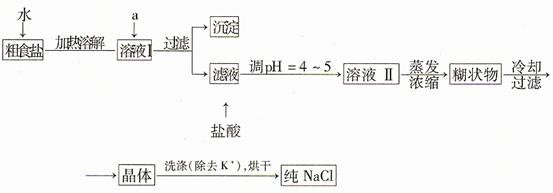
提供的試劑:飽和Na2CO3溶液 飽和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的+Ca2+、Mg2+、Fe3+、SO42-離子,選出a所代表的試劑,按滴加順序依次是 (只填化學式)。
②洗滌除去NaCl晶體表面附帶的少量KCl,選用的試劑為 。
 (2)用提純的NaCl配制500 mL
4.00 mol·L-1 NaCl溶液,所用儀器除藥匙、玻璃棒外還有
(填儀器名稱)。
(2)用提純的NaCl配制500 mL
4.00 mol·L-1 NaCl溶液,所用儀器除藥匙、玻璃棒外還有
(填儀器名稱)。
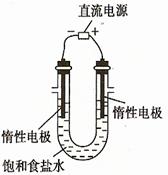
(3)電解飽和食鹽水的裝置如圖所示,若收集的H2為2 L,則同樣條件下收集的Cl2
(填“>”、“=”或“<”)2 L,原因是 。裝置改進后可用于制備NaOH溶液,若測定溶液中NaOH的濃度,常用的方法為 。
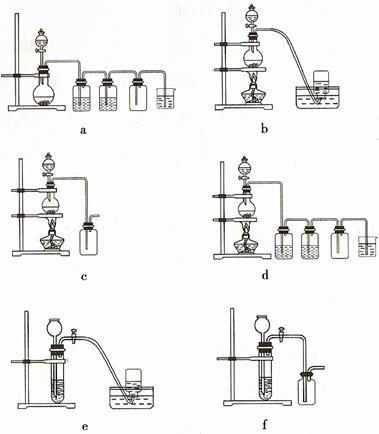
(4)實驗室制備H2和Cl2通常采用下列反應:
Zn+H2SO4=ZnSO4+H2↑
MnO2+4HCl(濃) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
據此,從下列所給儀器裝置中選擇制備并收集H2的裝置 (填代號)和制備并收集干燥、純凈Cl2的裝置 (填代號)。
可選用制備氣體的裝置:
29.答案:
(1)124.2
(2)C3H8+5O2=3CO2+4H2O 負
(3)4.2×10-7 mol·L-1
(4)> HCO3-+H2O=CO32-+H3O+(或HCO3-=CO32-+H+)、HCO3-+H2O=H2CO3+OH-,HCO3-的水解程度大于電離程度
解析:(1)將第2個方程式顛倒反寫,然后與第1個方程式相加,即得所求的反應C3H8(g)====CH3CH=CH2 (g)+H2(g),△H也隨方程式的變化關系進行求算:△H=-△H2+△H1=124.2kJ.mol-1。
(2)以丙烷為燃料制作的新型燃料電池,其電池反應方程式為C3H8十502=3C02+4H20,因電子從電池的負極經導線流入了電池的正極,故電池的正極是電子富集的一極,故帶負電荷的離子C032-在電解質溶液中應移向電池的負極而不是正極。
(3)根據電離平衡常數公式可知:
K1=c(H+)c(HCO3-)/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol. L-1。
(4)0.1 mol L-1NaHCO3溶液的pH大于8,說明溶液呈堿性,即c(OH-)>c(H+),因在NaHCO3溶液中存在著兩個平衡:電離平衡HCO3-
 CO32-+H+,水解平衡: HC03-+H20
CO32-+H+,水解平衡: HC03-+H20

 H2CO3-+OH-
,其余部分水的電離忽略不計,由c(OH-)>c(H+),說明水解過程大于電離過程,從而推出c(H2CO3)>c(CO32-)
。
H2CO3-+OH-
,其余部分水的電離忽略不計,由c(OH-)>c(H+),說明水解過程大于電離過程,從而推出c(H2CO3)>c(CO32-)
。
30.(12分)(08年山東理綜·29)北京奧運會“祥云”火炬燃料是丙烷(C3H8),亞特蘭大奧運會火炬燃料是丙烯(C3H6)。
(1)丙烷脫氫可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4
kJ·mol-1
CH(g ) △H2=32.4
kJ·mol-1
則相同條件下,反應C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷為燃料制作新型燃料電池,電池的正極通入O2和CO2,負極通入丙烷,電解質是熔融碳酸鹽。電池反應方程式為 ;放電時CO32-移向電池的 (填“正”或“負”)極。
(3)碳氫化合物完全燃燒生成CO2和H2O。常溫常壓下,空氣中的CO2溶于水,達到平衡時,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的電離及H2CO3的第二級電離,則H2CO3 HCO3-+H+的平衡常數K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常數K1=
。(已知10-5.60=2.5×10-6)
(4)常溫下,0.1 mol·L-1NaHCO3溶液的pH大于8,則溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用離子方程式和必要的文字說明)。
22.(11分)(1)Cu2S (2)Cu2O,Cu2S (3)形成酸雨,會對植物和建筑物造成嚴重損害 硫酸 硫酸銨 電解池中,粗銅作陽極,精銅作陰極,電解質為硫酸銅溶液。陽極上發生氧化反應,Cu失去電子,使Cu單質變為Cu2+進入溶液中Cu-2e- === Cu2+;陰極上發生還原反應,Cu2+得到電子在陰極上析出Cu單質,Cu2++2e- === Cu,從而達到精制Cu的目的 (5)A D
解析:
(1)上表所列銅化合物中,銅的質量百分含量最高的是Cu2S
解釋:CuFeS2:34.8% ;Cu5FeS4:63.5% ;Cu2S:80% ;CuCO3·Cu(OH)2:57.6%
(2) 反應的氧化劑是Cu2O,Cu2S
解釋:Cu2O,Cu2S的Cu由+1被還原為0價,作氧化劑;Cu2S的S有-2價被氧化為+4價,作還原劑。
(3) SO2尾氣直接排放到大氣中造成環境污染的后果是形成酸雨。處理該尾氣可得到有價值的化學品,寫出其中1種酸和1種鹽的名稱硫酸,硫酸銨。
解釋:處理SO2尾氣一般為循環制備硫酸,和用Ca(OH)2或氨水吸收,可得到CaSO4和(NH4)2SO4等有價值的化學品。
(4) 簡述粗銅電解得到精銅的原理:電解池中,粗銅作陽極,精銅作陰極,電解質為硫酸銅溶液。陽極上發生氧化反應,Cu失去電子,使Cu單質變為Cu2+進入溶液中Cu- e- == Cu2+;陰極上發生還原反應,Cu2+得到電子在陰極上析出Cu單質,Cu2++ e- == Cu,從而達到精制Cu的目的。
(5) A.D
解釋:稀鹽酸可以同Cu(OH)2與CuCO3反應,而且稀鹽酸不能于Cu反應。所以稀鹽酸可以除銅器表面的銅綠(CuCO3·Cu(OH)2),A正確。
銅表面不能形成致密氧化膜;銅和濃硫酸在常溫下是反應的,生成硫酸銅、SO2和水,反應很慢,反應過程中放熱,隨著反應的進行,速率會越來越快的,所以不能用銅制容器裝濃硫酸,B錯誤。
因為Fe比Cu活潑,所以Fe-Cu形成的原電池中,Fe作負極,更容易被氧化生繡,C錯誤。
藍色硫酸銅晶體受熱轉化為白色硫酸銅粉末,只有舊鍵的斷裂,沒有新鍵的形成(CuSO4·5H2O中,H2O與Cu2+有配位鍵),故不屬于化學變化,只有物理變化;CuSO4可用作消毒劑,但與前者沒有因果關系,D正確。
綜上所述,答案選AD。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com