
題目列表(包括答案和解析)
方案一:
(1)稱取碳酸鈣樣品Mg;
(2)用cmol·L-1的鹽酸VmL(過量)溶解樣品;
(3)取溶解后的溶液的十分之一,用c′mol·L-1NaOH溶液滴定,恰好用去V′mL。
問題①:列出本實驗中所用到的玻璃儀器名稱_____________________________________。
問題②:加鹽酸后是否需要濾出SiO2后再用NaOH溶液滴定__________(填選項代號)
A.需要 B.不需要 C.均可
問題③:碳酸鈣純度計算公式___________________________________________。
方案二:
(1)稱取碳酸鈣樣品Mg;
(2)高溫燒煅到1 000℃直至質量不再改變,冷卻后稱量,質量為M′g。
問題①:為什么要煅燒至1 000℃且“直至質量不再改變”?
______________________________________________________________
問題②:本方案中的“冷卻”應如何操作?
______________________________________________________________
方案三:
(1)稱取碳酸鈣樣品Mg;
(2)加入足量cmol·L-1鹽酸VmL使之完全溶解;
(3)過濾并取濾液;
(4)在濾液中加入過量c′mol·L-1Na2CO3溶液V′mL;
(5)將步驟(4)中的沉淀濾出洗滌,干燥、稱重為M′g。
問題①:此方案中可以不需要的數據是__________(填選項代號)。
A.c、V B.c′、V′ C.M′ D.M
問題②:步驟(5)中要將沉淀進行洗滌,如果未經洗滌,則測定結果:碳酸鈣純度將_________(偏高、偏低、無影響)
綜上所述,你認為三個方案中,最好的方案是__________。其他方案的缺點分別是:方案三:沉淀的洗滌、干燥、稱量操作過程復雜,容易造成較大誤差。方案_________,_________。
| 熔點/℃ | 沸點/℃ | 密度/g?mL | 其他 | |||||||||
| 黃磷 | 44.1 | 280.5 | 1.82 | 2P(過量)+3Cl2
2P+5Cl2(過量)
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于 PCl3 |
| ||
| ||
(c1V1-
| ||
| m |
(c1V1-
| ||
| m |
欲測定含少量氯化鈉的小蘇打固態樣品中NaHCO3的質量分數可采用以下四種方法。
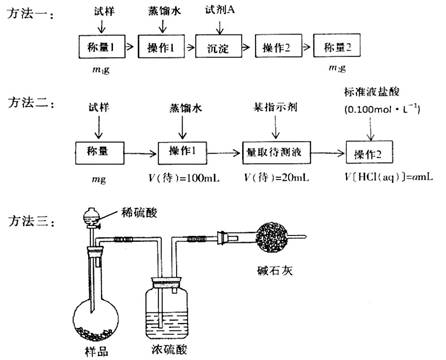
方法四:不使用化學試劑,使用實驗室常用儀器。
按要求回答下列問題:
(1)方法一是將HCO3-離子轉化為沉淀并稱重,則試劑A為______________(填化學式)溶液;操作2包括_______________________。
(2)方法二操作1中要用到的玻璃儀器有燒杯、玻璃棒,還需要___________________;操作2的名稱是__________;該樣品中NaHCO3的質量分數為_________(用含m、a的表達式表示)。
(3)根據方法三中所用的實驗裝置,除了稱量試樣質量外,還需測定的實驗數據是_______________;仔細分析該實驗裝置,由此測得的數據計算出的實驗結果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。
(4)方法四的實驗原理是________________(用化學方程式表示)。
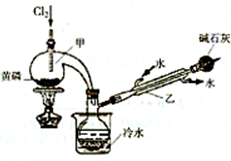
(15分)PCl3可用于半導體生產的外延、擴散工序。有關物質的部分性質如下:
(一)制備
下圖是實驗室制備PCI3的裝置(部分儀器已省略)
(1)儀器乙的名稱 ;
(2)實驗室制備Cl2的離子方程式: ;
(3)堿石灰的作用是 , ;
(4)向儀器甲中通人干燥Cl2之前,應先通人一段時間的CO2,其目的是 。
(二)提純
粗產品中常含有POCl3、PCl5等。加入黃磷加熱除去PCl5后,通過____(填實驗操作名稱),即可得到PCl3的純品。
(三)分析
測定產品中PCl3純度的方法如下:迅速稱取m,g產品,水解完全后配成500mL溶液,取出25.00mL加入過量的c1mol·L-lV1mL碘溶液,充分反應后再用c2mol·L-1Na2S2O3溶液滴定過量的碘,終點時消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假設測定過程中沒有其他反應。
根據上述數據,該產品中PCl3的質量分數為 (用含字母的代數式表示、不必化簡)
(1)甲同學用如圖一所示裝置,通過測定放出CO2的體積來確定碳酸鈉的質量分數,結果誤差較大,請你提出改進措施_______________________。

(2)乙同學用圖二所示裝置,通過測定反應放出CO2的質量來確定碳酸鈉的質量分數,他重復正確操作三次,結果數據出現了較大偏差。你認為主要原因可能是(任寫兩個)
①__________________________________________________________________,
②__________________________________________________________________。
(3)丙同學認為上面的測定方法誤差都較大,提出用中和滴定來測定。方法是:準確稱取氫氧化鈉樣品mg,放入錐形瓶中加蒸餾水溶解,加1—2滴酚酞指示劑,用物質的量濃度為c mol·L-1的HCl溶液滴定至溶液由紅色至無色(指示![]() +H+
+H+![]()
![]() 反應的終點),消耗HCl溶液體積為V1mL,再加入1—2滴甲基橙指示劑,繼續用HCl溶液滴定至溶液由黃變橙(指示H++
反應的終點),消耗HCl溶液體積為V1mL,再加入1—2滴甲基橙指示劑,繼續用HCl溶液滴定至溶液由黃變橙(指示H++![]()
![]() CO2↑+H2O反應的終點),又消耗HCl溶液體積為V2mL。則燒堿樣品中Na2CO3的質量分數為_____________________。
CO2↑+H2O反應的終點),又消耗HCl溶液體積為V2mL。則燒堿樣品中Na2CO3的質量分數為_____________________。
(4)請你設計另外一個簡單的實驗方案來測定NaOH固體混合物中Na2CO3的質量分數。
①寫出操作步驟。
②用測得的數據(用字母表示)寫出質量分數的表達式_______________。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com