
題目列表(包括答案和解析)
實驗室用加熱二氧化錳與濃鹽酸的混合物制備氯氣:
MnO2+4HCl(濃)一套完整的氯氣實驗室制備裝置應該由四部分構成
(如圖).同學們需要注意實驗儀器的連接和作用.
A.分液漏斗:用來盛放液體試劑,本實驗用來盛裝濃鹽酸.
B.圓底燒瓶:做反應容器,內放固體物質,本實驗盛裝的是固體二氧化錳.在加濃鹽酸時要注意液體的量不能超過燒瓶容積的________,而且加熱時要________,使燒瓶底部均勻受熱,避免受熱不均而炸裂.
C.除雜裝置:第一個洗氣瓶內盛有飽和食鹽水,它的作用是除去氯氣中混有的氯化氫雜質;第二個洗氣瓶內盛有濃硫酸,用于除去氯氣中混有的水蒸氣.洗氣瓶中兩個導管的插入原則是“長進短出”.除雜的順序是先除氯化氫,后除水蒸氣.如果順序顛倒,不能起到除雜的作用,原因是________.
D.集氣裝置:用來收集密度比空氣大的氣體要用向上排空氣法.如果不需要收集干燥的氯氣,也可以使用________的方法.
E.尾氣吸收:因為氯氣有毒,會污染環境,多余的氯氣不能排放到大氣中,選用________進行尾氣處理.
將一定量的氯酸鉀與3.48g二氧化錳組成的混合物加熱一段時間后共收集到氧氣0.336L(標準狀況),然后將殘留固體加入到足量濃鹽酸中共熱,使之與濃鹽酸充分反應,再將生成的氣體全部通入到100ml1mol/L的溴化亞鐵溶液中,有一半的溴離子被氧化成單質.求氯酸鉀的分解率.

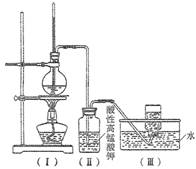
(8分)如圖,在實驗室里,通常利用濃硫酸與乙醇混合加熱制乙烯,加熱一段時間后溶液中出現棕色、黑色現象。過一段時間后,發現硫酸酸化的高錳酸鉀溶液褪色。
![]() 甲同學認為酸性高錳酸鉀溶液褪色,能證明乙烯被酸性高錳酸鉀溶液氧化了;乙同學認為酸性高錳酸鉀溶液褪色,不能證明乙烯被酸性高錳酸鉀溶液氧化了。
甲同學認為酸性高錳酸鉀溶液褪色,能證明乙烯被酸性高錳酸鉀溶液氧化了;乙同學認為酸性高錳酸鉀溶液褪色,不能證明乙烯被酸性高錳酸鉀溶液氧化了。
![]()
(1)
(1)你認為哪個同學的觀點正確? (填“甲”或“乙”),理由是 。
A.(Ⅱ)瓶中酸性高錳酸鉀溶液褪色,能證明乙烯發生了氧化反應
B.(Ⅱ)瓶中酸性高錳酸鉀溶液褪色,能證明乙烯發生了加成反應
C.(Ⅱ)瓶中酸性高錳酸鉀溶液褪色,不能證明通入的氣體是純凈物
D.(Ⅱ)瓶中酸性高錳酸鉀溶液褪色,只能證明通入氣體一定具有還原性
(2)丙同學取(Ⅱ)瓶中少量溶液于試管里,加入鹽酸和氯化鋇溶液,產生白色沉淀,他認為乙烯中一定混有二氧化硫,你認為他的結論是否可靠? (填“可靠”或“不可靠”);理由是 。若你認為不可靠,改進上述實驗方案,證明乙烯中是否含有![]() 的改進方法是 。
的改進方法是 。
(3)丁同學對上述實驗方案進行了適當改進,用于證明乙烯能否發生加成反應,他的改進方法是 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com