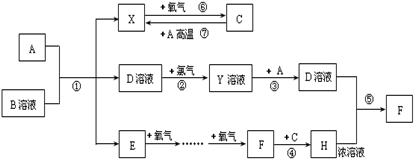
A、B、C、D、E五種短周期元素,原子序數依次增大,A、E同主族,A元素的原子半徑最小,B元素原子的最外層電子數是內層電子數的2倍,C元素的最高價氧化物的水化物X與其氫化物反應生成一種鹽Y,A、B、C、E四種元素都能與D元素形成原子個數比不相同的常見化合物.回答下列問題:
(1)常溫下,X、Y的水溶液的pH均為5.則兩種水溶液中由水電離出的H
+濃度之比是
10-4:1
10-4:1
.
(2)A、B、D、E四種元素組成的某無機化合物,受熱易分解.寫出少量該化合物溶液與足量的Ba(OH)
2溶液反應的離子方程式
Ba2++HCO3-+OH-═BaCO3↓+H2O
Ba2++HCO3-+OH-═BaCO3↓+H2O
.
(3)A、B、D、E四種元素組成的某無機化合物濃度為0.1mol/L時,pH最接近
C
C
.
A.5.6B.7.0 C.8.4D.13.0
(4)在一個裝有可移動活塞的容器中進行如下反應:C
2(g)+3A
2(g)

2CA
3(g)
△H=-92.4kJ?mol
-1.反應達到平衡后,測得容器中含有C
2 0.5mol,A
2 0.2mol,CA
3 0.2mol,總容積為1.0L.
①如果達成此平衡前各物質起始的量有以下幾種可能,其中不合理的是
BC
BC
:
A.C
2 0.6mol,A
2 0.5mol,CA
3 0mol
B.C
2 0mol,A
2 0mol,CA
3 1.2mol
C.C
2 0.6mol/L,A
2 0.5mol/L,CA
3 0.2mol/L
②求算此平衡體系的平衡常數K=
10
10
;
③如果保持溫度和壓強不變,向上述平衡體系中加入0.18molC
2,平衡將
逆向
逆向
(填“正向”、“逆向”或“不”)移動.理由是
原平衡體系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,當加入N
2,體系瞬間有分子0.9mol+0.18ml=1.08mol,瞬間總體積為1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移動
原平衡體系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,當加入N
2,體系瞬間有分子0.9mol+0.18ml=1.08mol,瞬間總體積為1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移動
.
④已知0.4mol 液態C
2 A
4與足量的液態雙氧水反應,生成C
2和水蒸氣,放出256.65kJ的熱量.寫出該反應的熱化學方程式
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
.

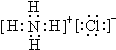


 2CA3(g)
2CA3(g)



