
題目列表(包括答案和解析)
(14 分) 一氧化碳被廣泛應用于冶金工業和電子工業。
⑴高爐煉鐵是最為普遍的煉鐵方法,相關反應的熱化學方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反應3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代數式表示)。
⑵電子工業中使用的一氧化碳常以甲醇為原料通過脫氫、分解兩步反應得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反應的機理可以用下圖表示: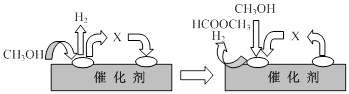
圖中中間產物X的結構簡式為 。
②在工業生產中,為提高CO的產率,可采取的合理措施有 。
⑶為進行相關研究,用CO還原高鋁鐵礦石,反應后固體物質的X—射線衍射譜圖如圖所示(X—射線衍射可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同)。反應后混合物中的一種產物能與鹽酸反應生產兩種鹽,該反應的離子方程式為 。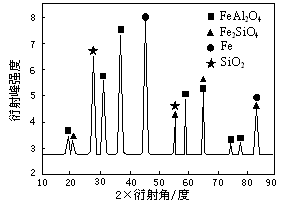
⑷某催化劑樣品(含Ni2O340%,其余為SiO2)通過還原、提純兩步獲得鎳單質:首先用CO將33.2 g樣品在加熱條件下還原為粗鎳;然后在常溫下使粗鎳中的Ni與CO結合成Ni(CO)4(沸點43 ℃),并在180 ℃時使Ni(CO)4重新分解產生鎳單質。
上述兩步中消耗CO的物質的量之比為 。
⑸為安全起見,工業生產中需對空氣中的CO進行監測。
①粉紅色的PdCl2溶液可以檢驗空氣中少量的CO。若空氣中含CO,則溶液中會產生黑色的Pd沉淀。每生成5.3gPd沉淀,反應轉移電子數為 。
②使用電化學一氧化碳氣體傳感器定量檢測空氣中CO含量,其結構如圖所示。這種傳感器利用原電池原理,則該電池的負極反應式為 。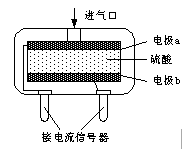
(14 分) 一氧化碳被廣泛應用于冶金工業和電子工業。
⑴高爐煉鐵是最為普遍的煉鐵方法,相關反應的熱化學方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反應3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代數式表示)。
⑵電子工業中使用的一氧化碳常以甲醇為原料通過脫氫、分解兩步反應得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反應的機理可以用下圖表示: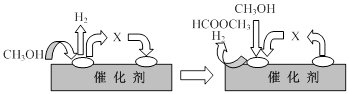
圖中中間產物X的結構簡式為 。
②在工業生產中,為提高CO的產率,可采取的合理措施有 。
⑶為進行相關研究,用CO還原高鋁鐵礦石,反應后固體物質的X—射線衍射譜圖如圖所示(X—射線衍射可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同)。反應后混合物中的一種產物能與鹽酸反應生產兩種鹽,該反應的離子方程式為 。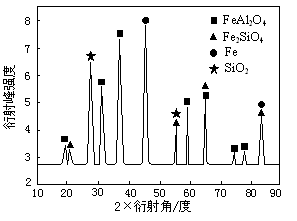
⑷某催化劑樣品(含Ni2O340%,其余為SiO2)通過還原、提純兩步獲得鎳單質:首先用CO將33.2 g樣品在加熱條件下還原為粗鎳;然后在常溫下使粗鎳中的Ni與CO結合成Ni(CO)4(沸點43 ℃),并在180 ℃時使Ni(CO)4重新分解產生鎳單質。
上述兩步中消耗CO的物質的量之比為 。
⑸為安全起見,工業生產中需對空氣中的CO進行監測。
①粉紅色的PdCl2溶液可以檢驗空氣中少量的CO。若空氣中含CO,則溶液中會產生黑色的Pd沉淀。每生成5.3gPd沉淀,反應轉移電子數為 。
②使用電化學一氧化碳氣體傳感器定量檢測空氣中CO含量,其結構如圖所示。這種傳感器利用原電池原理,則該電池的負極反應式為 。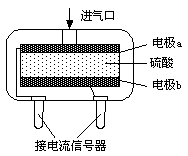
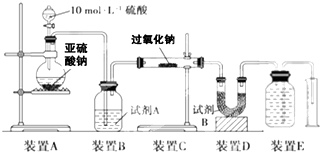
| 7m1 |
| 30 |
| 7m1 |
| 30 |
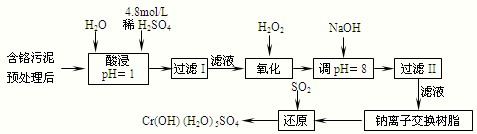
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com