
題目列表(包括答案和解析)
 (09江蘇卷)下列有關實驗操作的敘述正確的是:
(09江蘇卷)下列有關實驗操作的敘述正確的是:
A.實驗室常用右圖所示的裝置制取少量的乙酸乙酯
B.用50mL酸式滴定管可準確量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 鹽酸于50mL容量瓶中,
加水稀釋至刻度,可配制0.100mol·L-1 鹽酸
D.用苯萃取溴水中的溴,分液時有機層從分液漏斗的下端放出
[2012·江蘇卷] (14分)廢棄物的綜合利用既有利于節約資源,又有利于保護環境。實驗室利用廢舊電池的銅帽(Cu、Zn總含量約為99%)回收 Cu并制備ZnO的部分實驗過程如下: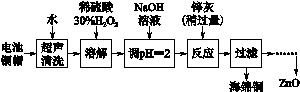
(2)①銅帽溶解時加入H2O2的目的是______ _____________________(用化學方程式表示)。
②銅帽溶解完全后,需將溶液中過量的H2O2除去。除去H2O2的簡便方法____ ___。
(3)為確定加入鋅灰(主要成分為Zn、ZnO,雜質為鐵及其氧化物)的量,實驗中需測定除去H2O2后溶液中Cu2+的含量。實驗操作為:準確量取一定體積的含有Cu2+的溶液于帶塞錐形瓶中,加適量水稀釋,調節溶液pH=3~4,加入過量的KI,用Na2S2O3標準溶液滴定至終點。上述過程中反應的離子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O32-+I2===2I-+S4O62-
①滴定選用的指示劑為________,滴定終點觀察到的現象____________________。
②若滴定前溶液中的H2O2沒有除盡,所測定的Cu2+含量將會________(填“偏高”、“偏低”或“ 不變”)。
已知pH>11時Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了幾種離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0 mol·L-1計算)。
| | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
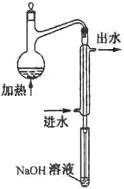
(08年江蘇卷)(10分)金礦開采、冶煉和電鍍工業會產生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金屬離子的配離子M(CN)nm-的形式存在于水中。測定污水中含氰化合物含量的實驗步驟如下:
①水樣預處理:水樣中加入磷酸和EDTA,在pH<2的條件下加熱蒸餾,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:將吸收液調節至pH>11,以試銀靈作指示劑,用AgNO3標準溶液滴定
 Ag++2CN - == [Ag(CN)2] -
Ag++2CN - == [Ag(CN)2] -
終點時,溶液由黃色變成橙紅色。
根據以上知識回答下列問題:
⑴水樣預處理的目的是 。
⑵水樣預處理的裝置如右圖,細導管插入吸收液中是為了 ____
⑶蒸餾瓶比吸收液面要高出很多,其目的是 。
⑷如果用鹽酸代替磷酸進行預處理,實驗結果將 (填“偏高”、“無影響”或“偏低”)。
⑸準確移取某工廠污水100mL,經處理后用濃度為0.01000mol?L-1的硝酸銀標準溶液滴定,終點時消耗了21.00mL。此水樣中含氰化合物的含量為 mg?L-1的(以計,計算結果保留一位小數)。
(05年江蘇卷)(10分)水垢可以看作由多種物質組成的混合物,為研究含有Ca2+、Mg2+、HCO![]() 的水所形成水垢的化學組成,取干燥的水垢6.32g,加熱使其失去結晶水,得到5.78g剩余固體A;高溫灼燒A至恒重,殘余固體為CaO和MgO,放出的氣體用過量的Ba(OH)2溶液吸收,得到11.82g沉淀。
的水所形成水垢的化學組成,取干燥的水垢6.32g,加熱使其失去結晶水,得到5.78g剩余固體A;高溫灼燒A至恒重,殘余固體為CaO和MgO,放出的氣體用過量的Ba(OH)2溶液吸收,得到11.82g沉淀。
(1)通過計算確定A中是否含有碳酸鎂;
(2)5.78g剩余固體A灼燒至恒重時產生的氣體完全被堿石灰吸收,堿石灰增重
2.82g,通過計算確定A中各成分的物質的量,并計算出水垢中碳酸鹽的質量分數。
(05年江蘇卷)在一定體積pH=12的Ba(OH)2溶液中,逐滴加入一定物質的量濃度的NaHSO4溶液,當溶液中的Ba2+恰好完全沉淀時,溶液pH=11。若反應后溶液的體積等于Ba(OH)2溶液與NaHSO4溶液的體積之和,則Ba(OH)2溶液與NaHSO4溶液的體積比是 ()
A.1:9 B.1:1 C.1:2 D.1:4
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com