
題目列表(包括答案和解析)
含有弱酸HA和其鈉鹽NaA的混合溶液,在化學上用作緩沖溶液。向其中加入少量酸或堿時,溶液的酸堿性變化不大。
(1)向該溶液中加入少量鹽酸時,發生反應的離子方程式是 ,向其中加入少量KOH溶液時,發生反應的離子方程式是
(2)現將0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等體積混合,得到緩沖溶液。①若HA為HCN,該溶液顯堿性,則溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出該結論的依據是
②若HA為CH3COOH,該溶液顯酸性。溶液中所有的離子按濃度由大到小排列的順序是
某密閉容器中加入0.3 molA 、0.1 molC和一定量的B三種氣體。一定條件下發生反應,各物質濃度隨時間變化如圖甲所示[t0-t1階段 c ( B)未畫出]。圖乙為t2后改變互不相同的某一條件反應速率跟時間的關系,已知,t3 - t4階段使用催化劑。下列說法正確的是
A.若 t1= 15 s,生成物C在 t0-t1時間段的平均反應速率為 0.004mol·L-1·s-1
B.t4 - t5階段改變的條件為降低反應溫度
C.B的起始物質的量為 0.02mol
D.t5-t6改變的條件是增大反應物濃度

將0.03mol Cl2緩緩通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此過程中C(H+)與Cl2用量的關系是

A B
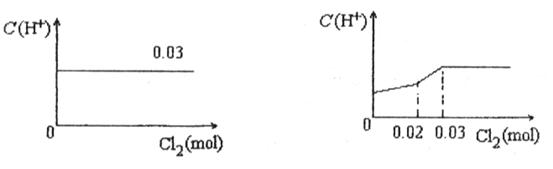
C D
在2L密閉容器內,按物質的量之比為2:1投入NO 和O2.某溫度下發生如下反應:2NO(g)+O2(g)?2NO2(g),n(NO)隨時間的變化如表:
|
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com