
題目列表(包括答案和解析)
| 產品標準 | GB5461 |
| 產品等級 | 一級 |
| 配 料 | 食鹽、碘酸鉀、抗結劑 |
| 碘含量(以I計算) | 20~50mg/kg |
| 分裝日期 | \ |
| 分裝企業 | \ |
亞氯酸鈉(NaClO2)常用于水的消毒和砂糖、油脂的漂白與殺菌。以下是用過氧化氫法生產亞氯酸鈉的工藝流程圖:

已知:NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO2·3H2O。
(1)吸收塔內發生反應的化學方程式為_____________________(配平化學方程式)。該工藝流程中的NaClO3、ClO2、NaClO2都是強氧化劑,它們都能和濃鹽酸反應制取Cl2。若用二氧化氯和濃鹽酸制取Cl2,當生成5 mol Cl2時,通過還原反應制得氯氣的質量為________克。
(2)從濾液中得到的NaClO2·3H2O晶體的操作依次是__________(填寫序號)。
a.蒸餾 b.灼燒 c.過濾 d.冷卻結晶
(3)印染工業常用亞氯酸鈉(NaClO2)漂白織物,漂白織物時真正起作用的是HClO2。下表是25℃時HClO2 及幾種常見弱酸的電離平衡常數:

①常溫下,物質的量濃度相等的NaClO2 、NaF、NaCN、Na2S四種溶液的pH由大到小的順序為____________;體積相等,物質的量濃度相同的NaF、NaCN兩溶液中所含陰陽離子總數的大小關系為:______________(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀劑。某工業污水中含有等濃度的Cu2+、Fe2+、Pb2+ 離子,滴加Na2S溶液后首先析出的沉淀是_______;當最后一種離子沉淀完全時(該離子濃度為10-5mol·L-1)此時的S2-的濃度為____。
已知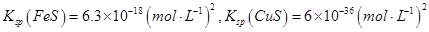



金屬鈣線是煉制優質鋼材的脫氧脫磷劑,某鈣線的主要成分為金屬M和Ca,并含有3.5%(質量分數)的CaO.
(1)Ca元素在周期表中位置是________,其原子結構示意圖________.
(2)Ca與最活躍的非金屬元素A形成化合物D,D的電子式為________,比A與Si形成的化合物為E.D的沸點比E的沸點________(填“高”或“低”).
(3)配平化學方程式:________P+________FeO+________CaO-________Ca3(PO4)2+________Fe
(4)將鈣線試樣溶于稀鹽酸后,加入過量NaOH溶液,生成白色絮狀沉淀并迅速變成灰綠色,最后變成紅褐色M(OH)n,則金屬M為________(填名稱);檢測Mn+的方法是________(用離子方程式表達).
(5)取1.6 g鈣線試樣,與水充分反應,生成448 mL H2(標準狀況),再向溶液中通入適量的CO2,最多能得到CaCO3________g.
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com