
題目列表(包括答案和解析)
已知:I2+2S2O32-=2I-+S4O62-。某學(xué)生測(cè)定食用碘鹽中碘的含量,其步驟為:
a. 準(zhǔn)確稱取w g食鹽,加適量蒸餾水使其完全溶解
b. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3與KI反應(yīng)完全
c. 以淀粉為指示劑,逐滴加入物質(zhì)的量濃度為2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反應(yīng)完全。則所測(cè)鹽中碘的含量是(以含w的代數(shù)表示) mg/kg。
加碘食鹽中通常加入的是KIO3,該物質(zhì)在酸性條件下表現(xiàn)出較強(qiáng)的氧化性,可以和碘化物、亞硫酸鹽等還原性物質(zhì)發(fā)生反應(yīng)。
(1)寫出KIO3與KI在稀硫酸介質(zhì)中發(fā)生反應(yīng)的離子方程式______________________
(2)為測(cè)定菜加碘鹽中碘元素的含量,某學(xué)生甲設(shè)計(jì)了如下實(shí)驗(yàn):
A.準(zhǔn)確稱取wg食鹽,使其完全溶解在適量的蒸餾水中;
B.用稀硫酸酸化所得溶液,加入過(guò)量的KI溶液,使其充分反應(yīng);
C.以___________________為指示劑,運(yùn)滴加入物質(zhì)的量濃度為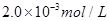 的硫代硫酸鈉溶液10.0mL,恰好完全反應(yīng),判斷反應(yīng)完全的實(shí)驗(yàn)現(xiàn)象為____________________________________,則該加碘鹽樣品中碘元素的含量為______________________mg/Kg(用含w的代數(shù)式表示)。
的硫代硫酸鈉溶液10.0mL,恰好完全反應(yīng),判斷反應(yīng)完全的實(shí)驗(yàn)現(xiàn)象為____________________________________,則該加碘鹽樣品中碘元素的含量為______________________mg/Kg(用含w的代數(shù)式表示)。
(已知: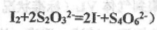 )
)
(3)某學(xué)生乙又進(jìn)行了下列實(shí)驗(yàn):
A.準(zhǔn)確稱取1.0g純凈的NaCl,加3mL蒸餾水配成溶液,溶液為無(wú)色;
B.滴入5滴指示劑和1mL 0.lmol/L Kl溶液,充分振蕩,溶液不變化;
C.繼續(xù)滴加l滴1mol/L的硫酸溶液,充分振蕩,溶液變藍(lán)色
推測(cè)實(shí)驗(yàn)中產(chǎn)生藍(lán)色現(xiàn)象的原因,用離子方程式表示________________________
根據(jù)學(xué)生乙的實(shí)驗(yàn)結(jié)果,請(qǐng)對(duì)學(xué)生甲的實(shí)驗(yàn)結(jié)果進(jìn)行分________________________(偏大、偏小、正確),其原因是________________________________________________.
加碘食鹽中通常加入的是KIO3,該物質(zhì)在酸性條件下表現(xiàn)出較強(qiáng)的氧化性,可以和碘化物、亞硫酸鹽等還原性物質(zhì)發(fā)生反應(yīng)。
(1)寫出KIO3與KI在稀硫酸介質(zhì)中發(fā)生反應(yīng)的離子方程式______________________
(2)為測(cè)定菜加碘鹽中碘元素的含量,某學(xué)生甲設(shè)計(jì)了如下實(shí)驗(yàn):
A.準(zhǔn)確稱取wg食鹽,使其完全溶解在適量的蒸餾水中;
B.用稀硫酸酸化所得溶液,加入過(guò)量的KI溶液,使其充分反應(yīng);
C.以___________________為指示劑,運(yùn)滴加入物質(zhì)的量濃度為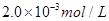 的硫代硫酸鈉溶液10.0mL,恰好完全反應(yīng),判斷反應(yīng)完全的實(shí)驗(yàn)現(xiàn)象為____________________________________,則該加碘鹽樣品中碘元素的含量為______________________mg/Kg(用含w的代數(shù)式表示)。
的硫代硫酸鈉溶液10.0mL,恰好完全反應(yīng),判斷反應(yīng)完全的實(shí)驗(yàn)現(xiàn)象為____________________________________,則該加碘鹽樣品中碘元素的含量為______________________mg/Kg(用含w的代數(shù)式表示)。
(已知: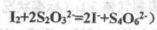 )
)
(3)某學(xué)生乙又進(jìn)行了下列實(shí)驗(yàn):
A.準(zhǔn)確稱取1.0g純凈的NaCl,加3mL蒸餾水配成溶液,溶液為無(wú)色;
B.滴入5滴指示劑和1mL 0.lmol/L Kl溶液,充分振蕩,溶液不變化;
C.繼續(xù)滴加l滴1mol/L的硫酸溶液,充分振蕩,溶液變藍(lán)色
推測(cè)實(shí)驗(yàn)中產(chǎn)生藍(lán)色現(xiàn)象的原因,用離子方程式表示________________________
根據(jù)學(xué)生乙的實(shí)驗(yàn)結(jié)果,請(qǐng)對(duì)學(xué)生甲的實(shí)驗(yàn)結(jié)果進(jìn)行分________________________(偏大、偏小、正確),其原因是________________________________________________.
產(chǎn)品標(biāo)準(zhǔn) 產(chǎn)品等級(jí) 配料 碘含量(以Ⅰ計(jì)算) 分裝日期 分裝企業(yè) | GB5461 一級(jí) 食鹽、碘酸鉀、抗結(jié)劑 20—50mg/kg 2007.1.25
|
1.上述精制鹽屬于_________(填“純凈物”或“混合物”)。
2.如果含碘量達(dá)到50mg/kg,則精制食鹽中碘酸鉀的質(zhì)量分?jǐn)?shù)為___________。
3.配平下列化學(xué)方程式。
______KIO3+______KI+______H2SO4![]() ______K2SO4+______I2+______H2O
______K2SO4+______I2+______H2O
(1)反應(yīng)中作氧化劑的是________;
(2)當(dāng)溶液中生成0.5 mol I2時(shí),電子轉(zhuǎn)移總數(shù)為________________個(gè)。
4.已知:I2+2![]()
![]() 2I-+
2I-+![]() 某學(xué)生測(cè)定食用精鹽的碘含量,步驟為:
某學(xué)生測(cè)定食用精鹽的碘含量,步驟為:
a.準(zhǔn)確稱取W g食鹽,加適量蒸餾水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3和KI完全反應(yīng);
c.以淀粉為指示劑,逐滴加入物質(zhì)的量濃度為
2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好完全反應(yīng)。
(1)判斷c中反應(yīng)恰好完全的依據(jù)現(xiàn)象是________________;
(2)b中反應(yīng)所產(chǎn)生的I2的物質(zhì)的量是________________mol;
(3)計(jì)算:根據(jù)以上實(shí)驗(yàn)和包裝袋上的說(shuō)明所測(cè)精制鹽的碘含量(以含W的代數(shù)式表示)。
(11分)碘是人體的必需微量元素之一。加碘食鹽中加重主的碘酸鉀是一種白色結(jié)晶粉末,常溫下很穩(wěn)定。在酸性條件下碘酸鉀是一種較強(qiáng)的氧化劑,可與碘化物等還原性物質(zhì)反應(yīng)。
I.工業(yè)生產(chǎn)碘碳鉀的流程如下:
|
已知步驟①發(fā)生反應(yīng)為6I2+11KclO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
反應(yīng)中還原劑是 (填化學(xué)式),轉(zhuǎn)移電子數(shù)為 。
II、已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)檢驗(yàn)加碘食物中的碘元素。
學(xué)生甲利用碘酸與碘化鉀在酸性條件下發(fā)生反應(yīng),檢驗(yàn)是否有碘單質(zhì)生成所需要的試劑是 ,判斷碘單質(zhì)存在的現(xiàn)象是 ;若要進(jìn)一步分離提純碘單質(zhì),用到的主要玻璃儀器有 。
(2)測(cè)定加碘食鹽中碘的含量。學(xué)生乙設(shè)計(jì)的實(shí)驗(yàn)步驟如下:
a.準(zhǔn)確稱取wg食鹽,加適量蒸餾水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入過(guò)量KI溶液,使KIO3與KI反應(yīng)完全;
c.以淀粉為指示劑,逐滴加入物質(zhì)的量濃度為2.0×10-3mol/L的Ns2S2O3溶液10.0mL,恰好完全反應(yīng)(I2+2S2O2-3=2I-+S4O2-6)。則加碘食鹽樣品中的碘元素含量是 mg./kg(以含w的代數(shù)式表示)。
(3)有人認(rèn)為可以用碘化鉀代替食鹽中的碘酸鉀,學(xué)生丙又進(jìn)行了下列實(shí)驗(yàn):
| 操作步驟 | 實(shí)驗(yàn)現(xiàn)象 |
| 取1g純凈的NaCl,加3mL水配成溶液。 | 溶液無(wú)變化 |
| 滴入5滴淀粉溶液和1ml0.1mol/L KI溶液,振蕩。 | 溶液無(wú)變化 |
| 然后再加入少量食醋,振蕩。 | 溶液變藍(lán)色 |
根據(jù)學(xué)生丙的實(shí)驗(yàn)結(jié)果,回答下列問(wèn)題
①你認(rèn)為能否用碘化鉀代替食鹽中的碘酸鉀 (填“能、不能或不確定”)②你認(rèn)為學(xué)生乙的實(shí)驗(yàn)結(jié)果 (填“偏高、偏低、無(wú)影響”)。
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com