
題目列表(包括答案和解析)
 某化學興趣小組對乙酸乙酯的制備實驗進行改進,裝置如圖所示.甲乙丙三個同學看了裝置圖后有自己的見解:甲認為該實驗改進不合理,在實驗時會發生倒吸而發生意外;乙認為實驗改進后乙酸乙酯中混有的乙酸和乙醇能更好的被飽和碳酸鈉溶液所吸收,只要實驗結束先把導管從碳酸鈉溶液中取出,再停止加熱即可防止溶液倒吸;丙認為反應的試管中連接的玻璃導管起到防止倒吸的作用,把導管插入碳酸鈉溶液中更有利于雜質被充分吸收.你認為他們中正確的是( )
某化學興趣小組對乙酸乙酯的制備實驗進行改進,裝置如圖所示.甲乙丙三個同學看了裝置圖后有自己的見解:甲認為該實驗改進不合理,在實驗時會發生倒吸而發生意外;乙認為實驗改進后乙酸乙酯中混有的乙酸和乙醇能更好的被飽和碳酸鈉溶液所吸收,只要實驗結束先把導管從碳酸鈉溶液中取出,再停止加熱即可防止溶液倒吸;丙認為反應的試管中連接的玻璃導管起到防止倒吸的作用,把導管插入碳酸鈉溶液中更有利于雜質被充分吸收.你認為他們中正確的是( )| A、甲 | B、乙 | C、丙 | D、都不正確 |
在某一容積為2 L的密閉容器內,加入0.8 mol的H2和0.6 mol的I2,在一定的條件下發生如下反應:
H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
反應中各物質的濃度隨時間變化情況如圖1:
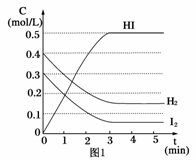
(1)根據圖1數據,反應開始至達到平衡時,平衡速率v(HI)為____________。
(2)反應達到平衡后,第8分鐘時:
①若升高溫度,化學平衡常數K____________(填寫增大、減小或不變)
HI濃度的變化正確的是____________(用圖2中a-c的編號回答)
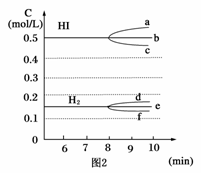
②若加入I2,H2濃度的變化正確的是____________。(用圖2中d-f的編號回答)
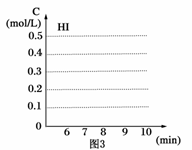
(3)反應達到平衡后,第8分鐘時,若把容器的容積擴大一倍,請在圖3中畫出8分鐘后HI濃度的變化情況。
www.k@s@5@u.com 高#考#資#源#網
(1)現行高中化學課本第一冊的學生實驗一中設計了CuO對KClO3分解的催化作用的實驗,某化學興趣小組對此產生了興趣,研究CuO和MnO2對KClO3分解的催化性能。
實驗裝置:

圖4-3
實驗記錄:
實驗序號 | 試管中藥品 | 加熱時間 | 待測數據 |
1 | 20s |
| |
2 | 20s |
|
問題與討論
①這里的待測數據是__________________________;
②測氣體的體積,是選裝置(Ⅰ)還是選裝置(Ⅱ)?__________________________;
③實驗開始時,是先把導管通入量筒中,還是先加熱?理由是什么?
____________________________________________________________________
④實驗時間到后,應如何操作?
____________________________________________________________________
(2)已知下列反應:2H2O2+2KMnO4+3H2SO4=K2SO4+MnSO4+5O2↑+8H2O。學生在做此實驗時發現:在敞口容器中,當H2O2與酸化的KMnO4溶液混合后,開始產生氧氣的速率很慢,一段時間后產生氧氣的速率很迅速,經測定溶液的溫度基本沒變,該學生經過思考認為不可能是溫度、濃度、壓強的影響,只可能是催化劑的影響。為了證實自己的推斷,設計了以下對比實驗:
①空白實驗 ②起始時加入少量K2SO4固體
③起始時加少量______________ ④起始加入少量水
實驗結果:起始反應速率③最快,④最慢,①②基本相同
請解釋實驗①過程中現象產生的原因:_____________________________________________。
| |||||||||||||||||||||||||||||||
| 選項 | 鋁電極 | 電解質 | 負極反應 | 正極反應 |
| A | 負極 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 負極 | 稀鹽酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正極 | 濃硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com