
題目列表(包括答案和解析)
運用化學反應原理研究氮、氧等元素的單質及其化合物的反應有重要意義。
Ⅰ.(1)一定溫度和壓強下,反應N2(g) + 3H2(g) ![]() 2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡 (填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH (填“增大”、“減小”或“不改變”)。
2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡 (填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH (填“增大”、“減小”或“不改變”)。
(2)在一定溫度和壓強下,已知:
O2 (g) = O2+ (g) + e-;![]() H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e- = PtF6- (g);![]() H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
O2PtF6 (s) = O2+ (g) + PtF6- (g);![]() H3= 482.2 kJ/mol
H3= 482.2 kJ/mol
則反應O2 (g) + PtF6 (g) = O2PtF6 (s);![]() H=_____________ kJ/mol。
H=_____________ kJ/mol。
Ⅱ.現有常溫下的六種溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液與pH=12的氨水等體積混合后所得溶液;⑥0.01 mol/L HCl溶液與pH=12的NaOH溶液等體積混合所得溶液。
(1)⑤、⑥溶液比較,pH較大的是 。
(2)六種溶液中,水的電離程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,則消耗溶液的體積:②________ ③(選填“>”、“<”或“=”)。
(4)稀釋相同倍數后,溶液的pH:① ②,③ ④(選填“>”、“<”或“=”)。
(16分)
運用化學反應原理研究氮、氧等元素的單質及其化合物的反應有重要意義。
Ⅰ.(1)一定溫度和壓強下,反應N2(g) + 3H2(g) 2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡 (填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH (填“增大”、“減小”或“不改變”)。
(2)在一定溫度和壓強下,已知:
O2 (g) = O2+(g) + e-;![]() H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e-= PtF6- (g);![]() H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
O2PtF6 (s)= O2+ (g) + PtF6- (g); H3=482.2 kJ/mol
H3=482.2 kJ/mol
則反應O2 (g) + PtF6 (g) =O2PtF6 (s);![]() H=_____________ kJ/mol。
H=_____________ kJ/mol。
Ⅱ.現有常溫下的六種溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/L CH3COOH溶液與pH=12的氨水等體積混合后所得溶液;⑥0.01 mol/L HCl溶液與pH=12的NaOH溶液等體積混合所得溶液。
(1)⑤、⑥溶液比較,pH較大的是 。
(2)六種溶液中,水的電離程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,則消耗溶液的體積:②________ ③(選填“>”、“<”或“=”)。
(4)稀釋相同倍數后,溶液的pH:① ②,③ ④(選填“>”、“<”或“=”)。
(16分)
運用化學反應原理研究氮、氧等元素的單質及其化合物的反應有重要意義。 Ⅰ.(1)一定溫度和壓強下,反應N2(g) + 3H2(g)
Ⅰ.(1)一定溫度和壓強下,反應N2(g) + 3H2(g)  2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡 (填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH (填“增大”、“減小”或“不改變”)。
2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡 (填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH (填“增大”、“減小”或“不改變”)。 (2)在一定溫度和壓強下,已知:
(2)在一定溫度和壓強下,已知:
O2 (g) = O2+ (g) + e-; H1=" 1175.7" kJ/mol
H1=" 1175.7" kJ/mol PtF6 (g) + e- = PtF6- (g);
PtF6 (g) + e- = PtF6- (g); H2=" ―771.1" kJ/mol
H2=" ―771.1" kJ/mol O2PtF6 (s) = O2+ (g) + PtF6- (g);
O2PtF6 (s) = O2+ (g) + PtF6- (g);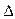 H3=" 482.2" kJ/mol
H3=" 482.2" kJ/mol 則反應O2 (g) + PtF6 (g) = O2PtF6(s);
則反應O2 (g) + PtF6 (g) = O2PtF6(s); H="_____________" kJ/mol。
H="_____________" kJ/mol。 Ⅱ.現有常溫下的六種溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液與pH=12的氨水等體積混合后所得溶液;⑥0.01 mol/L HCl溶液與pH=12的NaOH溶液等體積混合所得溶液。
Ⅱ.現有常溫下的六種溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液與pH=12的氨水等體積混合后所得溶液;⑥0.01 mol/L HCl溶液與pH=12的NaOH溶液等體積混合所得溶液。
(1)⑤、⑥溶液比較,pH較大的是 。
(2)六種溶液中,水的電離程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,則消耗溶液的體積:②________ ③(選填“>”、“<”或“=”)。
(4)稀釋相同倍數后,溶液的pH:① ②,③ ④(選填“>”、“<”或“=”)。
(16分)
運用化學反應原理研究氮、氧等元素的單質及其化合物的反應有重要意義。
Ⅰ.(1)一定溫度和壓強下,反應N2(g) + 3H2(g)  2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡
(填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH
(填“增大”、“減小”或“不改變”)。
2NH3(g)達到化學平衡狀態。若向平衡體系中通入氬氣,平衡
(填“向左”、“向右”或“不”)移動;若使用活性更強的催化劑,該反應的ΔH
(填“增大”、“減小”或“不改變”)。
 (2)在一定溫度和壓強下,已知:
(2)在一定溫度和壓強下,已知:
O2 (g) = O2+
(g) + e-;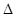 H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e-
= PtF6- (g);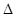 H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
 O2PtF6 (s)
= O2+ (g) + PtF6- (g);
O2PtF6 (s)
= O2+ (g) + PtF6- (g); H3=
482.2 kJ/mol
H3=
482.2 kJ/mol
則反應O2 (g) + PtF6 (g) =
O2PtF6 (s);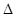 H=_____________ kJ/mol。
H=_____________ kJ/mol。
 Ⅱ.現有常溫下的六種溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01
mol/L CH3COOH溶液與pH=12的氨水等體積混合后所得溶液;⑥0.01 mol/L HCl溶液與pH=12的NaOH溶液等體積混合所得溶液。
Ⅱ.現有常溫下的六種溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01
mol/L CH3COOH溶液與pH=12的氨水等體積混合后所得溶液;⑥0.01 mol/L HCl溶液與pH=12的NaOH溶液等體積混合所得溶液。
(1)⑤、⑥溶液比較,pH較大的是 。
(2)六種溶液中,水的電離程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,則消耗溶液的體積:②________ ③(選填“>”、“<”或“=”)。
(4)稀釋相同倍數后,溶液的pH:① ②,③ ④(選填“>”、“<”或“=”)。
| [HCOO-] | [HCOOH]?[OH-] |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com