
題目列表(包括答案和解析)
醫(yī)用氯化鈣可用于生產(chǎn)補鈣、抗過敏和消炎等藥物。以工業(yè)碳酸鈣(含有少量Na+、Al3+、Fe3+、Cu2+等雜質(zhì))生產(chǎn)醫(yī)藥級二水合氯化鈣(CaCl2?2H2O的質(zhì)量分數(shù)為97.0%~103.0%)的主要流程如下:
![]()
![]()
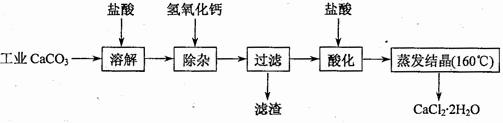
![]() (1)除雜操作是加入氫氧化鈣,調(diào)節(jié)溶液的pH,以除去溶液中的少量Al3+、Fe3+、Cu2+。
(1)除雜操作是加入氫氧化鈣,調(diào)節(jié)溶液的pH,以除去溶液中的少量Al3+、Fe3+、Cu2+。
①已知Cu(OH)2的KSP=2×l0-20 (mol/L)3。要使0. 2mol?L-1CuCl2溶液中Cu2+沉淀較為完全(使Cu2+濃度降至原來的千分之一,此時Al3+、Fe3+已沉淀完全),則應(yīng)向溶液里加入強堿溶液至溶液的pH為______。
②檢驗Fe(OH)3已經(jīng)沉淀完全的實驗操作是 ;
③如果將氫氧化鈣改為純凈的碳酸鈣,請用離子方程式表達除去溶液中Fe3+的過程:
。
![]() (2)酸化操作是加入鹽酸,調(diào)節(jié)溶液的pH約為4.0,其主要目的是: 。
(2)酸化操作是加入鹽酸,調(diào)節(jié)溶液的pH約為4.0,其主要目的是: 。
![]() (3)測定樣品中Cl-含量的方法是:a.稱取0.75g樣品,溶解,在250mL容量瓶中定容;b.量取25.00mL待測溶液于錐形瓶中;c.用0.05mol?L-1AgNO3溶液滴定至終點,消耗AgNO3溶液體積的平均值為20.39mL。
(3)測定樣品中Cl-含量的方法是:a.稱取0.75g樣品,溶解,在250mL容量瓶中定容;b.量取25.00mL待測溶液于錐形瓶中;c.用0.05mol?L-1AgNO3溶液滴定至終點,消耗AgNO3溶液體積的平均值為20.39mL。
![]() ①上述測定過程中需要溶液潤洗的儀器有 。
①上述測定過程中需要溶液潤洗的儀器有 。
![]() ②量取25.00mL待測溶液于錐形瓶中時,如果開始滴定管的液面讀數(shù)為5.10mL,左手控制滴定管的活塞,使待測溶液流入錐形瓶中,眼睛注視著 ,直到 ,迅速關(guān)閉活塞。
②量取25.00mL待測溶液于錐形瓶中時,如果開始滴定管的液面讀數(shù)為5.10mL,左手控制滴定管的活塞,使待測溶液流入錐形瓶中,眼睛注視著 ,直到 ,迅速關(guān)閉活塞。
③計算上述所得樣品中CaCl2?2H2O的質(zhì)量分數(shù)為 。
![]() ④若用上述辦法測定的樣品中CaCl2?2H2O的質(zhì)量分數(shù)偏高(測定過程中產(chǎn)生的誤差可忽略),其可能原因有 ; 。
④若用上述辦法測定的樣品中CaCl2?2H2O的質(zhì)量分數(shù)偏高(測定過程中產(chǎn)生的誤差可忽略),其可能原因有 ; 。
Ⅰ.(4分)銅與稀硝酸反應(yīng)的離子方程式為________________;在做銅與稀硝酸反應(yīng)的實驗時,常觀察到試管內(nèi)生成的氣體先為淺紅棕色,其原因是________________;為了能直接觀察到生成的氣體的顏色,可在往稀硝酸中加入銅的同時,加入少量碳酸鹽,那么加入少量碳酸鹽的作用是________________。
Ⅱ.某研究性學習小組欲證明:在同溫同壓下,相同濃度、相同體積的酸性不同的一元酸與足量鎂帶反應(yīng)時,生成氫氣的體積相同而反應(yīng)速率不同,同時測定實驗室條件下的氣體摩爾體積。設(shè)計的簡易實驗裝置如下圖。該實驗的主要操作步驟如下:

①配制濃度均為1 mol?L-1鹽酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1鹽酸和醋酸溶液分別加入兩個錐形瓶中;
③分別稱取除去表面氧化膜的鎂帶a g,并系于銅絲末端;
④在廣口瓶中裝足量的水,按圖連接好裝置,檢查裝置的氣密性;
⑤將銅絲向下移動,使足量鎂帶浸入酸中(銅絲不與酸接觸),至反應(yīng)完全,記錄相關(guān)數(shù)據(jù);
⑥反應(yīng)結(jié)束后待溫度恢復(fù)到室溫,調(diào)整乙和丙中液面使二者處于同一平面,讀出量筒中水的體積為V mL。
請你參與實驗并回答下列問題:
(1)量取15.00 mL 1 mol?L-1鹽酸和醋酸溶液所用的儀器是 ;
A.帶刻度的燒杯 B.量筒 C.酸式滴定管 D.堿式滴定管
(2)步驟③中a的數(shù)值至少是 ;步驟④中檢查該裝置氣密性的操作與觀察方法是:____________________;步驟⑤中應(yīng)記錄的數(shù)據(jù)是 ;
(3)本實驗裝置丙中量筒的規(guī)格是 (填序號)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸氣的影響忽略不計,在實驗室條件下,氣體摩爾體積的計算式為:Vm=____;
(5)試簡述速率不等的原因是_________;銅絲不與酸接觸的原因是_______________。
(6)試寫出鎂與醋酸溶液反應(yīng)的離子方程式: 。
(11分)硫酸亞鐵銨的化學式為(NH4)2SO4•FeSO4•6H2O,商品名為莫爾鹽。可由硫酸亞鐵與硫酸銨反應(yīng)生成硫酸亞鐵銨,一般硫酸亞鐵鹽在空氣中易被氧化,而形成莫爾鹽后就比較穩(wěn)定了。三種鹽的溶解度(單位為g/100g水)如下表:
溫度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
(NH4)2SO4•FeSO4•6H2O | 17.2 | 26.4 | 33.0 | 46.0 | ― | ― |
(一)實驗室制取少量莫爾鹽的流程如下:
 |
試回答下列問題:
(1)步驟1中加入10%Na2CO3溶液的主要作用是除去鐵屑表面的油污,簡述其除去油污的原理
(2)將(NH4)2SO4與FeSO4混合后加熱、濃縮,停止加熱的時機
(3)步驟4中析出的晶體不含(NH4)2SO4和FeSO4的原因是 ,理論上制得的莫爾鹽的質(zhì)量為 。
(二)稱取兩份質(zhì)量均為1.96g的該硫酸亞鐵銨,制成溶液。用未知濃度的KMnO4酸性溶液進行滴定。
(1)滴定時,將KMnO4酸性溶液裝在_______(填“酸式”或“堿式”)滴定管。試寫出該滴定過程中的離子方程式:_ ___ __;
(2)判斷該反應(yīng)到達滴定終點的現(xiàn)象為 ;
(3)假設(shè)到達滴定終點時,用去V mL KMnO4酸性溶液,則該KMnO4酸性溶液的濃度為 mol/L
 2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,則平衡 移動(填“向左”“向右”或“不”);使用催化劑,上述反應(yīng)的△H________(填“增大” “減小” 或“不改變”)。
2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,則平衡 移動(填“向左”“向右”或“不”);使用催化劑,上述反應(yīng)的△H________(填“增大” “減小” 或“不改變”)。 式),生成該沉淀的離子方程式為____________。已知25℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成該沉淀的離子方程式為____________。已知25℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 中性,則Va︰Vb= 。
中性,則Va︰Vb= 。

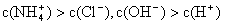

 NH3·H2O + H+,則該反應(yīng)常溫下的平衡常數(shù)K= (已知:常溫下,NH3·H2O的電離平衡常數(shù)Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,則該反應(yīng)常溫下的平衡常數(shù)K= (已知:常溫下,NH3·H2O的電離平衡常數(shù)Kb=1.7×10—5 mol·L—1)為了測定一定質(zhì)量的銅鋁混合物中銅的質(zhì)量分數(shù),某化學課外活動小組設(shè)計了如下兩個方案:
方案Ⅰ:銅鋁混合物![]() 測定生成氣體的體積
測定生成氣體的體積
方案Ⅱ:銅鋁混合物![]() 測定剩余固體的質(zhì)量
測定剩余固體的質(zhì)量
回答下列問題:
(1)小組成員一致認為兩個方案都可行,你認為在實驗室中選擇方案 更便于實施。
(2)小組成員一致認為兩個方案中可供選擇的溶液A和B有很多,你認為在兩個方案中溶液A和B均可選用的是 。(填編號)
A.稀鹽酸 B.氫氧化鈉溶液 C.硫酸銅溶液
(3)小組成員為探究Cu2+、Al3+在溶液中是否可以依次轉(zhuǎn)化為沉淀而析出,設(shè)計了如下實驗:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定濃度的NH3?H2O溶液,使混合溶液的PH值不斷升高,當加至溶液的體積為45 mL時Al3+開始反應(yīng)生成沉淀,當加至溶液的體積為50 mL時Cu2+開始反應(yīng)生成沉淀。(不考慮溶液的體積變化)
[查閱資料]:常溫下Ksp[Al(OH)3]=1.0×10-33mol?L-4,
Ksp[Cu(OH)2]=2.0×10-20mol?L-3。
請回答下列問題:
①Al(OH)3開始析出時溶液的PH應(yīng)大于 。
②若溶液中離子的濃度約為1.0×10-5 mol?L-時可視為沉淀完全,則當Al(OH)3沉淀完全時Cu(OH)2是否析出?
一、1.解析:Fe Fe2+
Fe2+ Fe3+
Fe3+ Fe(OH)3
Fe(OH)3 Fe2O3。
Fe2O3。
答案:A?
2.B 3.C?
4.解析:根據(jù)2Fe3++Fe===3Fe2+知,消耗1 mol Fe生成3 mol Fe2+,還消耗2 mol Fe3+。
答案:C?
5.C 6.A 7.B 8.A 9.C 10.AD?
二、11.Fe2O3 CO和H2 Fe3O4、FeO?
12.(1)白色沉淀 灰綠色
灰綠色 紅褐色沉淀?
紅褐色沉淀?
(2)3Fe+2NO +8H+===3Fe2++2NO↑+4H2O?
+8H+===3Fe2++2NO↑+4H2O?
(3)由反應(yīng)2HNO3+NO===3NO2+H2O知,在濃HNO3中不可能生成NO?
13.(1)Fe Cl2 H2?
(2)2Fe+3Cl2 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑?
(4)2FeCl2+Cl2===2FeCl3?
14.(1)Fe FeCl3 FeCl2 Fe(OH)3 Fe2O3 (2)略?
15.65 g 20.5%?
16.(1)ac?
(2)設(shè)Fe2O3原有n0 mol,還原百分率為A%,則有?


A%= ≈33.3%
≈33.3%
(3)3-
(4)Fe2O3、Fe3O4 8<a<9?
Fe3O4、FeO 6<a<8?
Fe2O3、Fe3O4、FeO 6<a<9
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com