
題目列表(包括答案和解析)
綠色化學對于化學反應提出了“原子經濟性”(原子節約)的新概念及要求。理想的原子經濟性反應是原料分子中的原子全部轉變成所需產物,不產生副產物,實現零排放。下列幾種生產乙苯的方法中,原子經濟性最好的是(反應均在一定條件下進行)
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C. ![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() →
→![]() +HBr;
+HBr;![]() +H2→
+H2→![]()

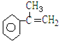 為主要原料合成:
為主要原料合成: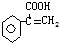



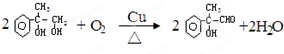
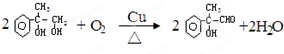
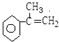 ,互為同分異構體,且能使溴水褪色,苯環上只有一個取代基,該有機物可能的結構簡式為:
,互為同分異構體,且能使溴水褪色,苯環上只有一個取代基,該有機物可能的結構簡式為:

(6分)一定溫度下,向一固定容積的密閉容器中充入氫氣和溴蒸氣發生反應:H2(g)+Br2(g) 2HBr(g)。達到平衡狀態后,下列說法中一定正確的是 ;能說明此反應達到平衡狀態的是 。
2HBr(g)。達到平衡狀態后,下列說法中一定正確的是 ;能說明此反應達到平衡狀態的是 。
A.單位時間內生成n mol H2的同時生成2n mol HBr
B.單位時間內生成n mol H2的同時生成n molBr2
C.一個H-H鍵斷裂的同時有兩個H-Br鍵斷裂
D.[HBr]∶[H2]∶[Br2]=2∶2∶1
E.溫度和體積一定時,某一生成物的濃度不再變化
F.溫度和體積一定時,容器內壓強不再變化
1200℃時可用反應 2BBr3(g)
+ 3H2(g) 2B(s)
+ 6HBr(g) 來制取晶體硼。完成下列填空:
2B(s)
+ 6HBr(g) 來制取晶體硼。完成下列填空:
(1)下列說法能說明該反應達到平衡的是______(選填序號,下同)。
a. v正(BBr3)= 3v逆(HBr) b. 2c(H2) = c(HBr)
c.密閉容器內壓強不再變化 d. 容器內氣體平均摩爾質量不再變化
(2)若密閉容器體積不變,升高溫度,晶體硼的質量增加,下列說法正確的是_________。
a. 在平衡移動時正反應速率先增大后減小
b. 在平衡移動時逆反應速率始終增大
c. 正反應為放熱反應
d. 達到新平衡后反應物不再轉化為生成物
(3)若上述反應在10L的密閉容器內反應,5min后,氣體總質量減少1.1 g,則該時間段內氫氣的平均反應速率為__________________。
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反應達到平衡后,混合氣體中HBr百分含量與起始通入H2的物質的量有如圖關系。在a、b、c三點中,H2 的轉化率最高的是______(選填字母)。b點達到平衡后,再充入H2使平衡到達c點,此過程中平衡移動的方向為__________(填“正向”、“逆向”或“不移動”)。

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com