
題目列表(包括答案和解析)
 CO2、SO2、NOx是重要的非金屬氧化物,與我們的生存環境息息相關.
CO2、SO2、NOx是重要的非金屬氧化物,與我們的生存環境息息相關.| C(HCO3-)C(OH-) |
| C(CO32-) |
| C(HCO3-)C(OH-) |
| C(CO32-) |
| 5 |
| 144 |
| 5 |
| 144 |
CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題。
(1)上述四種氣體直接排入空氣中會引起酸雨的有 。
(2) 可用尿素
可用尿素 還原(尿素中C元素的化合價為+4價),反應的方程式為:
還原(尿素中C元素的化合價為+4價),反應的方程式為: 。當消耗掉12g尿素時,轉移電子的物質的量是
。
。當消耗掉12g尿素時,轉移電子的物質的量是
。
(3)SNCR-SCR是一種新型的煙氣脫硝技術(除去煙氣中的 ),改流程中發生的主要反應有:
),改流程中發生的主要反應有:

則反應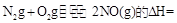 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反應方程式為 。在一容積可變的密閉容器中充有10mol CO和20molH2,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(a)與溫度(T)、壓強(P)的關系如圖所示。
。在一容積可變的密閉容器中充有10mol CO和20molH2,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(a)與溫度(T)、壓強(P)的關系如圖所示。
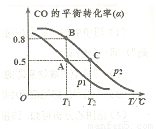
則該反應是 0(填“>”或“<”)。若達到平衡狀態A時,容器的體積為10L,則在平衡狀態B時容器的體積為 L。
0(填“>”或“<”)。若達到平衡狀態A時,容器的體積為10L,則在平衡狀態B時容器的體積為 L。
(5)工業上用氨水將來 轉化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中離子濃度大小順序為
;已知25℃時,0.05mol/L(NH4)2SO4溶液的
轉化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中離子濃度大小順序為
;已知25℃時,0.05mol/L(NH4)2SO4溶液的 ,則
,則 =
(用含a的代數式表示,已知
=
(用含a的代數式表示,已知 的電離常數
的電離常數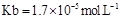 )。
)。
CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題。
(1)上述四種氣體直接排入空氣中會引起酸雨的有 。
(2)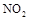 可用尿素
可用尿素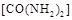 還原(尿素中C元素的化合價為+4價),反應的方程式為:
還原(尿素中C元素的化合價為+4價),反應的方程式為: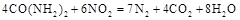 。當消耗掉12g尿素時,轉移電子的物質的量是 。
。當消耗掉12g尿素時,轉移電子的物質的量是 。
(3)SNCR-SCR是一種新型的煙氣脫硝技術(除去煙氣中的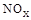 ),改流程中發生的主要反應有:
),改流程中發生的主要反應有: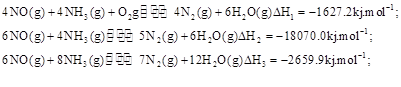
則反應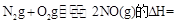 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反應方程式為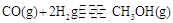 。在一容積可變的密閉容器中充有10mol CO和20molH2,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(a)與溫度(T)、壓強(P)的關系如圖所示。
。在一容積可變的密閉容器中充有10mol CO和20molH2,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(a)與溫度(T)、壓強(P)的關系如圖所示。
則該反應是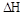 0(填“>”或“<”)。若達到平衡狀態A時,容器的體積為10L,則在平衡狀態B時容器的體積為 L。
0(填“>”或“<”)。若達到平衡狀態A時,容器的體積為10L,則在平衡狀態B時容器的體積為 L。
(5)工業上用氨水將來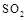 轉化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中離子濃度大小順序為 ;已知25℃時,0.05mol/L(NH4)2SO4溶液的
轉化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中離子濃度大小順序為 ;已知25℃時,0.05mol/L(NH4)2SO4溶液的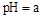 ,則
,則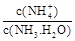 = (用含a的代數式表示,已知
= (用含a的代數式表示,已知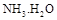 的電離常數
的電離常數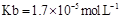 )。
)。
 CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題.
CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題.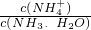 =______(用含a的代數式表示,已知NH3.H2O的電離常數Kb=1.7×10-5mol.L-1).
=______(用含a的代數式表示,已知NH3.H2O的電離常數Kb=1.7×10-5mol.L-1).研究CO 、NO2、SO2等大氣污染氣體的處理具有重要意義。
(1)CO可用于合成甲醇,反應方程式為:CO(g)+2H2(g)![]() CH3OH(g)。在一定條件下將2 mol CO和6 mol H2充入2L的密閉容器中發生反應,5分鐘后測得c(CO)=0.2 mol/L,計算此段時間的反應速率v(H2) =___________ mol/(L·min)。
CH3OH(g)。在一定條件下將2 mol CO和6 mol H2充入2L的密閉容器中發生反應,5分鐘后測得c(CO)=0.2 mol/L,計算此段時間的反應速率v(H2) =___________ mol/(L·min)。
CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示。該反應ΔH 0(填“>”或“ <”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此條件的理由是
。

(2)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —196.6 kJ·mol-1
2SO3(g) ΔH= —196.6 kJ·mol-1
2NO(g) + O2(g)![]() 2NO2(g) ΔH= —113.0 kJ·mol-1
2NO2(g) ΔH= —113.0 kJ·mol-1
則反應NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= kJ·mol-1。
SO3(g) + NO(g) 的ΔH= kJ·mol-1。
一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是 (填序號)。
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1 mol NO2的同時生成1 mol SO3
當測得上述反應平衡時NO2與SO2體積比為1:6,請列式計算反應NO2(g) + SO2(g)![]() SO3(g) + NO(g)的平衡常數K。
SO3(g) + NO(g)的平衡常數K。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com