
CO、NO、NO2、SO2等都是污染大氣的有害氣體,對其進行回收利用是節能減排的重要課題。
(1)上述四種氣體直接排入空氣中會引起酸雨的有 。
(2) 可用尿素
可用尿素 還原(尿素中C元素的化合價為+4價),反應的方程式為:
還原(尿素中C元素的化合價為+4價),反應的方程式為: 。當消耗掉12g尿素時,轉移電子的物質的量是
。
。當消耗掉12g尿素時,轉移電子的物質的量是
。
(3)SNCR-SCR是一種新型的煙氣脫硝技術(除去煙氣中的 ),改流程中發生的主要反應有:
),改流程中發生的主要反應有:

則反應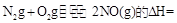 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反應方程式為 。在一容積可變的密閉容器中充有10mol CO和20molH2,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(a)與溫度(T)、壓強(P)的關系如圖所示。
。在一容積可變的密閉容器中充有10mol CO和20molH2,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(a)與溫度(T)、壓強(P)的關系如圖所示。
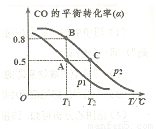
則該反應是 0(填“>”或“<”)。若達到平衡狀態A時,容器的體積為10L,則在平衡狀態B時容器的體積為 L。
0(填“>”或“<”)。若達到平衡狀態A時,容器的體積為10L,則在平衡狀態B時容器的體積為 L。
(5)工業上用氨水將來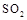 轉化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中離子濃度大小順序為
;已知25℃時,0.05mol/L(NH4)2SO4溶液的
轉化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中離子濃度大小順序為
;已知25℃時,0.05mol/L(NH4)2SO4溶液的 ,則
,則 =
(用含a的代數式表示,已知
=
(用含a的代數式表示,已知 的電離常數
的電離常數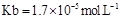 )。
)。
(1)NO、NO2、SO2(2分)
(2)1.2 mol(2分)
(3)179.8(2分)
(4)<(2分) 2(2分)
(5)c(NH4+)>c(SO42-)>c(H+)>c(OH-)(2分) 1.7×109-a (2分)
【解析】
試題分析:(1)酸雨分為硝酸型酸雨和硫酸型酸雨,所以NO、NO2、SO2都會引起酸雨。(2)尿素中C元素的化合價為+4價,反應中只有N元素變價,4molCO(NH2)2中-3價的N失去24mol電子,6molNO2中+4價的N得到24mol電子,生成7mol N2共轉移24mol電子,則12g(0.2mol)尿素時消耗時,共轉移1.2 mol電子。(3)求算反應N2(g)+O2(g)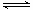 2NO(g)的ΔH,只用到前兩個反應,ΔH1-ΔH2即可得到。(4)據圖像可知,溫度升高平衡逆向移動,所以ΔH<0。T1時,A點對應的α=0.5,據平衡常數表達式可得K=1。因B點與A點溫度相同,K不變,可計算出體積為2L。(5)(NH4)2SO4溶液中NH4+水解顯酸性,則離子濃度大小順序為c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,則c(OH-)=10a-14,依據Kb的表達式和已知數據,可計算出結果為1.7×109-a。
2NO(g)的ΔH,只用到前兩個反應,ΔH1-ΔH2即可得到。(4)據圖像可知,溫度升高平衡逆向移動,所以ΔH<0。T1時,A點對應的α=0.5,據平衡常數表達式可得K=1。因B點與A點溫度相同,K不變,可計算出體積為2L。(5)(NH4)2SO4溶液中NH4+水解顯酸性,則離子濃度大小順序為c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,則c(OH-)=10a-14,依據Kb的表達式和已知數據,可計算出結果為1.7×109-a。
考點:本題以研究污染大氣的有害氣體性質為載體考查氧化還原反應、熱化學反應、化學平衡及電解質溶液的相關知識。


科目:高中化學 來源: 題型:

| ||
| △ |
| ||
| △ |
| b-2a |
| 2 |
| b-a |
| 2 |
| b-2a |
| 2 |
| b-a |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、工業上金屬Mg、Al都是用電解其相應的氯化物水溶液制得的 | B、日用鋁制品表面覆蓋著氧化膜,對內部金屬起保護作用 | C、CO、NO、NO2都是大氣污染氣體,在空氣中都能穩定存在 | D、為測定熔融氫氧化鈉的導電性,可將氫氧化鈉固體放在石英坩堝中加熱熔化 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com