
題目列表(包括答案和解析)
能源問題日益成為制約國際社會經濟發展的瓶頸,越來越多的國家開始實行“陽光計劃”,開發太陽能資源,尋求經濟發展的新動力。
(1) 太陽能熱水器中常使用一種以鎳或鎳合金空心球為吸收劑的太陽能吸熱涂層,寫出基態鎳原子的外圍電子排布式__________,它位于周期表____________區。
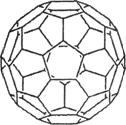
(2) 富勒烯衍生物由于具有良好的光電性能,在太陽能電池的應用上具有非常光明的前途。富勒烯(C60)的結構如右圖,分子中碳原子軌道的雜化類型為________;1 mol C60分子中σ鍵的數目為____________個。
(3) Cu單質晶體中原子的堆積方式如右圖甲所示,其晶胞特征如右圖乙所示,原子之間相互位置關系的平面圖如右圖丙所示。晶胞中Cu原子的配位數為____________,一個晶胞中Cu原子的數目為________。
(4) Fe(CO)5常溫下呈液態,熔點為-20.5 ℃,沸點為103 ℃,易溶于非極性溶劑,據此可判斷Fe(CO)5晶體屬于________(填晶體類型);Fe(CO)5是配合物,配體.配位數分別是________.________。
(5) 下列說法正確的是________。
A. 第一電離能大小:S>P>Si
B. 電負性順序:C<N<O<F
C. 因為晶格能CaO比KCl高,所以KCl比CaO熔點低
D. SO2與CO2的化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大
E. 分子晶體中,共價鍵鍵能越大,該分子晶體的熔.沸點越高
能源問題日益成為制約國際社會經濟發展的瓶頸,越來越多的國家開始實行“陽光計劃”,開發太陽能資源,尋求經濟發展的新動力。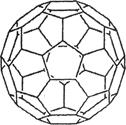
(1)太陽能熱水器中常使用一種以鎳或鎳合金空心球為吸收劑的太陽能吸熱涂層,寫出基態鎳原子的外圍電子排布式__________,它位于周期表____________區。
(2)富勒烯衍生物由于具有良好的光電性能,在太陽能電池的應用上具有非常光明的前途。富勒烯(C60)的結構如右圖,分子中碳原子軌道的雜化類型為________;1 mol C60分子中σ鍵的數目為____________個。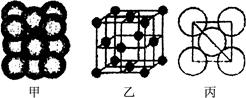
(3) Cu單質晶體中原子的堆積方式如右圖甲所示,其晶胞特征如右圖乙所示,原子之間相互位置關系的平面圖如右圖丙所示。晶胞中Cu原子的配位數為____________,一個晶胞中Cu原子的數目為________。
(4) Fe(CO)5常溫下呈液態,熔點為-20.5 ℃,沸點為103 ℃,易溶于非極性溶劑,據此可判斷Fe(CO)5晶體屬于________(填晶體類型);Fe(CO)5是配合物,配體.配位數分別是________.________。
(5)下列說法正確的是________。
| A.第一電離能大小:S>P>Si |
| B.電負性順序:C<N<O<F |
| C.因為晶格能CaO比KCl高,所以KCl比CaO熔點低 |
| D.SO2與CO2的化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大 |
能源問題日益成為制約國際社會經濟發展的瓶頸,越來越多的國家開始實行“陽光計劃”,開發太陽能資源,尋求經濟發展的新動力。
(1) 太陽能熱水器中常使用一種以鎳或鎳合金空心球為吸收劑的太陽能吸熱涂層,寫出基態鎳原子的外圍電子排布式__________,它位于周期表____________區。
(2) 富勒烯衍生物由于具有良好的光電性能,在太陽能電池的應用上具有非常光明的前途。富勒烯(C60)的結構如右圖,分子中碳原子軌道的雜化類型為________;1 mol C60分子中σ鍵的數目為____________個。
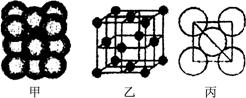
(3) Cu單質晶體中原子的堆積方式如右圖甲所示,其晶胞特征如右圖乙所示,原子之間相互位置關系的平面圖如右圖丙所示。晶胞中Cu原子的配位數為____________,一個晶胞中Cu原子的數目為________。
(4) Fe(CO)5常溫下呈液態,熔點為-20.5 ℃,沸點為103 ℃,易溶于非極性溶劑,據此可判斷Fe(CO)5晶體屬于________(填晶體類型);Fe(CO)5是配合物,配體.配位數分別是________.________。
(5) 下列說法正確的是________。
A. 第一電離能大小:S>P>Si
B. 電負性順序:C<N<O<F
C. 因為晶格能CaO比KCl高,所以KCl比CaO熔點低
D. SO2與CO2的化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大
E. 分子晶體中,共價鍵鍵能越大,該分子晶體的熔.沸點越高
不銹鋼是由鐵、鉻、鎳、碳及眾多不同元素所組成的合金,鐵是主要成分元素,鉻是第一主要的合金元素。其中鉻的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蝕。
(1)基態碳(C)原子的軌道表示式為 。
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位數為 ;已知CrO5中Cr為+6價,則CrO5的結構式為 。
(3)金屬鎳粉在CO氣流中輕微加熱,生成無色揮發性液態Ni(CO)4,呈四面體構型。423K時,Ni(CO)4分解為Ni和CO,從而制得高純度的Ni粉。試推測:四羰基鎳的晶體類型是 , Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸鎳溶液
(4)Fe的一種晶體如甲、乙所示,若按甲虛線方向切乙得到的A~B圖中正確的是 。


(5)據報道,只含鎂、鎳和碳三種元素的晶體竟然具有超導性。鑒于這三種元素都是常見元素,從而引起廣泛關注。該晶體的結構可看作由鎂原子和鎳原子在一起進行面心立方密堆積,試寫出該晶體的化學式 。晶體中每個鎂原子周圍距離最近的鎳原子有 個。
圖中:碳原子用小 |

“溫室效應” 是全球關注的環境問題之一。CO2是目前大氣中含量最高的一種溫室氣體。因此,控制和治理CO2是解決溫室效應的有效途徑。![]()
![]()
![]()
![]()
![]()
![]()
![]()

(1)下列措施中,有利于降低大氣中CO2濃度的有 。(填字母)
a.減少化石燃料的使用 b.植樹造林,增大植被面積
c.采用節能技術 d.利用太陽能、風能
(2)將CO2轉化成有機物可有效實現碳循環。CO2轉化成有機物的例子很多,如:
![]()
![]() a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
![]()
![]() c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
以上反應中,最節能的是 ,原子利用率最高的是 。
(3)文獻報道某課題組利用CO2催化氫化制甲烷的研究過程如下:

反應結束后,氣體中檢測到CH4和H2,濾液中檢測到HCOOH,固體中檢測到鎳粉和Fe3O4。CH4、HCOOH、H2的產量和鎳粉用量的關系如下圖所示(僅改變鎳粉用量,其他條件不變):

研究人員根據實驗結果得出結論:HCOOH是CO2轉化為CH4的中間體,即:
![]()
![]() CO2 HCOOH CH4
CO2 HCOOH CH4
①寫出產生H2的反應方程式 。
 ②由圖可知,鎳粉是 。(填字母)
②由圖可知,鎳粉是 。(填字母)
a.反應Ⅰ的催化劑
b.反應Ⅱ的催化劑
c.反應Ⅰ、Ⅱ的催化劑
d.不是催化劑![]()
![]()
![]()
![]()
![]()
![]()
![]()

③當鎳粉用量從1 mmol增加到10 mmol,反應速率的變化情況是 。(填字母)
a.反應Ⅰ的速率增加,反應Ⅱ的速率不變
b.反應Ⅰ的速率不變,反應Ⅱ的速率增加
c.反應Ⅰ、Ⅱ的速率均不變
d.反應Ⅰ、Ⅱ的速率均增加,且反應Ⅰ的速率增加得快
e.反應Ⅰ、Ⅱ的速率
均增加,且反應Ⅱ的速率增加得快
f.反應Ⅰ的速率減小,反應Ⅱ的速率增加
命題:林文土
6~~12 B B D A A C C
23、(19分)(1)2、5、6、7(3分,多選1個倒扣1分)
(2)①250mL容量瓶 34.75 (各1分)
②取最后的洗滌液,測定洗滌液的pH,若洗滌液的pH等于7,說明已經洗滌干凈(或取最后的洗滌液,向其中滴加BaCl2溶液,若無渾濁產生,則說明已經洗滌干凈。) (2分) ③ab (2分)
(3)Ⅰ、關閉活塞a、b,將出氣導管口浸沒在液面以下,用手掌或熱毛巾緊貼燒瓶外壁一小會兒,若出氣導管口有氣泡冒出,松手或拿走熱毛巾后導管內回升一段水柱,證明A裝置不漏氣。(2分)
Ⅱ、ACBECF(2分);
Ⅲ、①氫氧化鈉遇水放出大量熱,溫度升高,使氨的溶解度減小而放出;氫氧化鈉電離出的OH-增大了氨水中OH-濃度,促使氨水電離平衡左移,導致氨氣放出。(2分)
②4NH3十5O2 4NO+6H2O(2分)③說明氨的氧化反應是一個放熱反應(2分)
4NO+6H2O(2分)③說明氨的氧化反應是一個放熱反應(2分)
24、(13分)
Ⅰ(4分)(1)S2―>O2―>Na+ (2)SO2+Cl2+2H2O=2HCl+H2SO4(每空2分)
Ⅱ(4分)(1)Ag++e― =Ag,2H++2e―=H2↑ (2)2.24L(每空2分)
Ⅲ(2分)C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol―1
Ⅳ NaNO2(1分) 8 (2分)
25、(每空2分,共14分)
(1)Cl2+2OH-=Cl-+ClO-+H2O w.w.w.k.s.5 u.c.o.m;(2)C、濃H2SO4
(3)MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;(4)Na2SO4、O2
Mn2++Cl2↑+2H2O;(4)Na2SO4、O2
(5)AlCl3 NaAlO 2
2
(6)Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O[或3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O]
30、(共12分)
(1)1s22s22p63s23p63d84s2 (2分) (2) C≡O (2分) (3) 分子晶體(2分) 配位鍵(共價鍵)(2分) (4)MgCNi3 (2分) 12個(2分)
31、(共12分)(1) (2) (a) 消去反應 (b)
(2) (a) 消去反應 (b) 
(c) F中含碳碳雙鍵,羥基氧化時可能會同時氧化碳碳雙鍵,使最終不能有效、順利地轉化為B
(d)⑥
⑦
2009屆安溪縣高三年理綜統練生物試卷參考答案
命題:黃文堅
1-5:CACBC
26.(每空2分,共24分)
 Ⅰ(14分)Aa1、a1a2、a2a2 (2)1/4 , 1/2
(3)2/3 (4)(6分,親代表現型和后代表現型,以及表現型之比、親代和子代基因型,配子各1分)
Ⅰ(14分)Aa1、a1a2、a2a2 (2)1/4 , 1/2
(3)2/3 (4)(6分,親代表現型和后代表現型,以及表現型之比、親代和子代基因型,配子各1分)
II、(10分)基因庫 64% (2)自然選擇 (3)發生了進化,因為只要種群基因頻率改變,就是在進化;(4)沒有產生新物種,只是種群基因頻率改變,并沒有產生生殖隔離。
27.(共16分)(1)溫度、氧濃度、水分(2分)
(2)細胞中原來就存在這些特殊蛋白質基因,春化作用(低溫處理)激活了這些基因(2分)
(3)細胞分化(2分)特定基因表達或抑制(2分)
(4)選取粒大飽滿的冬小麥種子若干,浸種并使其萌芽,配制不同濃度梯度的赤霉素溶液。(2分)
對照組:冬小麥幼苗10株,不經低溫和赤霉素處理(2分)
實驗組A:冬小麥幼苗10株,低溫處理(2分)
實驗組B:不經低溫,然后用不同濃度梯度的赤霉素溶液處理,每種濃度的赤霉素溶液處理10株冬小麥幼苗。(2分)(其它如表格形式等合理答案也可)
32.(共10分)(1) ①目的基因的檢測與表達 ②DNA聚合 ③脫分化(1分) 再分化(1分) ④ABC (2)篩選和檢測
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com