
“溫室效應” 是全球關注的環境問題之一。CO2是目前大氣中含量最高的一種溫室氣體。因此,控制和治理CO2是解決溫室效應的有效途徑。![]()
![]()
![]()
![]()
![]()
![]()
![]()

(1)下列措施中,有利于降低大氣中CO2濃度的有 。(填字母)
a.減少化石燃料的使用 b.植樹造林,增大植被面積
c.采用節能技術 d.利用太陽能、風能
(2)將CO2轉化成有機物可有效實現碳循環。CO2轉化成有機物的例子很多,如:
![]()
![]() a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
![]()
![]() c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
以上反應中,最節能的是 ,原子利用率最高的是 。
(3)文獻報道某課題組利用CO2催化氫化制甲烷的研究過程如下:

反應結束后,氣體中檢測到CH4和H2,濾液中檢測到HCOOH,固體中檢測到鎳粉和Fe3O4。CH4、HCOOH、H2的產量和鎳粉用量的關系如下圖所示(僅改變鎳粉用量,其他條件不變):

研究人員根據實驗結果得出結論:HCOOH是CO2轉化為CH4的中間體,即:
![]()
![]() CO2 HCOOH CH4
CO2 HCOOH CH4
①寫出產生H2的反應方程式 。
 ②由圖可知,鎳粉是 。(填字母)
②由圖可知,鎳粉是 。(填字母)
a.反應Ⅰ的催化劑
b.反應Ⅱ的催化劑
c.反應Ⅰ、Ⅱ的催化劑
d.不是催化劑![]()
![]()
![]()
![]()
![]()
![]()
![]()

③當鎳粉用量從1 mmol增加到10 mmol,反應速率的變化情況是 。(填字母)
a.反應Ⅰ的速率增加,反應Ⅱ的速率不變
b.反應Ⅰ的速率不變,反應Ⅱ的速率增加
c.反應Ⅰ、Ⅱ的速率均不變
d.反應Ⅰ、Ⅱ的速率均增加,且反應Ⅰ的速率增加得快
e.反應Ⅰ、Ⅱ的速率
均增加,且反應Ⅱ的速率增加得快
f.反應Ⅰ的速率減小,反應Ⅱ的速率增加
(1)abcd (2)a c
![]() (3)①3Fe+4H2O(g) Fe3O4+4H2 ②c ③e
(3)①3Fe+4H2O(g) Fe3O4+4H2 ②c ③e
(1)a、c、d的措施可以減少CO2的產生,而b可以大量消耗CO2,故a、b、c、d都應選。
(2)a不需外加能源,節能;c無副產物,原子利用率最高。
![]() (3)①3Fe+4H2O(g) Fe3O4+4H2
(3)①3Fe+4H2O(g) Fe3O4+4H2
②由圖表中看出隨鎳粉增加H2量迅速減少,說明是反應Ⅰ的催化劑,HCOOH量也迅速減少,說明也是反應Ⅱ的催化劑。
③當鎳從1 mmol增加到10 mmol,H2和HCOOH的量仍在減少,說明反應Ⅰ和反應Ⅱ的反應速率都增加,但甲烷的增加量明顯快于H2的減少量,說明反應Ⅱ增加得快。


 習題精選系列答案
習題精選系列答案科目:高中化學 來源: 題型:
| 物質 | 大氣中的含量 (體積百分比) |
溫室效應 指數 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
 ,分子為平面結構.N2O4分子中N原子的雜化方式為
,分子為平面結構.N2O4分子中N原子的雜化方式為

| 共價鍵 | C-C | C-N | C-S |
| 鍵能/kJ?mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| △ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 哥本哈根世界氣候大會全稱《聯合國氣候變化框架公約》第15次締約方會議暨《京都議定書》第5次締約方會議,于2009年12月7~18日在丹麥首都哥本哈根召開.來自192個國家的談判代表召開峰會,商討《京都議定書》一期承諾到期后的后續方案,即2012~2020年的全球減排協議.
哥本哈根世界氣候大會全稱《聯合國氣候變化框架公約》第15次締約方會議暨《京都議定書》第5次締約方會議,于2009年12月7~18日在丹麥首都哥本哈根召開.來自192個國家的談判代表召開峰會,商討《京都議定書》一期承諾到期后的后續方案,即2012~2020年的全球減排協議.| 序號 | 預測現象 | 實驗結論 |
| A | ||
| B | ||
| C |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
閱讀下列短文,完成以下4題
英國國家海洋學中心于2009年8月14日發布新聞公報說,中心的研究人員及其同行利用聲吶等手段探測到北極海洋中存在大量甲烷氣泡,證實了全球變暖會使海底釋放大量甲烷的說法。研究人員認為,這些甲烷可能會反過來加劇全球變暖。
(1)已知天然氣的主要成分CH4是一種會產生溫室效應的氣體,等物質的量的CH4和CO2產生的溫室效應,前者大。下面是有關天然氣的幾種敘述,其中正確的是( )
①天然氣與煤、柴油相比是較清潔的能源;②等質量的CH4和CO2產生的溫室效應也是前者大;③燃燒天然氣也是酸雨的成因之一
A.①②③ B.只有① C.①和② D.只有③
(2)可燃冰又稱天然氣水合物,它是海底的高壓、低溫條件下形成的,外觀像冰。其化學式為8CH4·46H2O,1體積可燃冰可貯載100~200體積的天然氣。下面關于可燃冰的敘述不正確的是( )
A.可燃冰有可能成為人類未來的重要能源
B.可燃冰是一種比較潔凈的能源
C.可燃冰提供了水可能變成油的例證
D.可燃冰的主要可燃成分是甲烷
(3)下列事實、事件、事故中與甲烷無關的是( )
A.天然氣的主要成分
B.造成“光化學煙霧”的氣體
C.“西氣東輸”工程
D.煤礦中的瓦斯爆炸
(4)下列敘述中正確的是( )
A.在通常情況下,甲烷與高錳酸鉀等強氧化劑不反應,與強酸、強堿也不反應
B.甲烷燃燒能放出大量的熱,所以它是一種很好的氣體燃料,但點燃甲烷不必像點燃氫氣那樣事先驗純
C.甲烷分子是空間正方體結構,甲烷分子中4個碳氫鍵是完全等同的
D.1 mol CH4與4mol Cl2發生取代反應后,測得四種有機取代物的物質的量相等
查看答案和解析>>
科目:高中化學 來源:2010年銀川二中高考預測(綜合題)化學卷 題型:實驗題
運用化學反應原理研究碳的氧化物的性質具有重要意義。
(1)CO2是一種重要的物質,但其過量排放,可能導致全球氣溫升高。下列措施不能夠有效控制CO2所導致的溫室效應的是_________(填序號)
①大力發展低碳產業,提倡低碳生活,依法控制CO2的過量排放
②禁止濫砍濫伐,植樹造林,恢復生態
③開發利用各種新型能源代替煤、石油、天然氣等化石能源
④提倡使用脫硫煤、無鉛汽油等清潔燃料
(2)常溫下,碳酸在水中的電離常數Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的電離常數Ka =4.7×10-8。寫出84消毒液露置在空氣中發生反應的離子方程式___________________________。
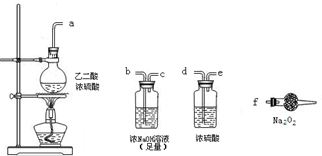
(3)CO具有還原性,某同學設計圖示裝置(固定裝置及膠管略去)驗證CO氣體能否與Na2O2反應。
已知: ,則實驗選擇的最簡單的裝置接口連接順序為________;
,則實驗選擇的最簡單的裝置接口連接順序為________;
若CO能夠與Na2O2發生反應,則預測反應產物為____________。實驗后用球形干燥管中的固體進行驗證可選擇的試劑是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H="-393.5" kJ·mol -1 ;CO(g)+ O2(g)=CO2(g),△H="-283.0" kJ·mol -1,寫出CO2和C(s)反應的熱化學方程式___________________。以CO為燃料制作燃料電池,電池的正極通入O2和CO2,負極通入CO,電解質是熔融碳酸鹽,放電時負極反應式為______________________。若使用該電池電解飽和食鹽水制取1molNaClO,則理論上需要氧氣的體積為(標準狀況下)________L。
O2(g)=CO2(g),△H="-283.0" kJ·mol -1,寫出CO2和C(s)反應的熱化學方程式___________________。以CO為燃料制作燃料電池,電池的正極通入O2和CO2,負極通入CO,電解質是熔融碳酸鹽,放電時負極反應式為______________________。若使用該電池電解飽和食鹽水制取1molNaClO,則理論上需要氧氣的體積為(標準狀況下)________L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com