
題目列表(包括答案和解析)

不同元素的原子在分子內吸引電子的能力大小可用x 表示,x越大、其原子吸引電子的能力越強,在所形成的分子中成為帶負電荷的一方,下面是某些短周期元素的 x 值。
| 元素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
⑴通過分析 x 值的變化規律,確定 Mg、N 的 x 值范圍:
x ( Mg ): , x ( N ): 。
⑵x 值與原子半徑的大小有什么關系? , 短周期元素 x 值的變化特點體現了元素性質的 變化規律。
⑶某有機物的結構簡式為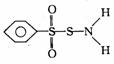 其中S―N鍵中你認為電子對偏向 。
其中S―N鍵中你認為電子對偏向 。
⑷經驗規律告訴我們,當成健的兩原子相應元素的 x 差值(△x)大于1.7時一般形成離子鍵,。△x<1.7時一般形成共價鍵,試判斷:AlBr3中化學鍵的類型是 。
⑸預測元素周期表中, x 值最小的元素位置: (放射性元素除外)。
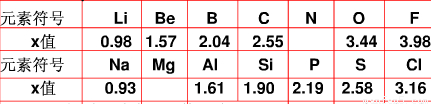
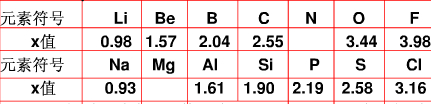
不同元素的原子在分子內吸引電子的能力大小可用x表示,x越大,其原子吸引電子的能力越強,在所形成的分子中成為帶負電荷的一方.下面是某些短周期元素的x值.
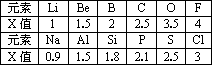
(1)通過分析x值的變化規律,確定Mg、N的x值范圍
Mg:________、N:________.
(2)短周期元素x值的變化特點體現了元素性質的________變化規律.
(3)某有機物分子中含有S-N鍵,你認為電子對偏向________原子(填元素符號).
(4)經驗規律告訴我們,當成鍵的兩原子相應元素的x差值Δx大于1.7時一般形成離子鍵,Δx小于1.7時一般形成共價鍵,試預測:AlBr3中化學鍵的類型是________.
設計實驗驗證你的預測________.
一、選擇題(本題包括9小題,每小題3分,共27分。每小題只有一個選項符合題意)
題號
1
2
3
4
5
6
7
8
9
答案
D
B
A
A
C
D
C
D
B
二、選擇題(本題包括9小題,每小題4分,共36分。每小題有一個或兩個選項符合題意。若正確答案只包括一個選項,多選時,該題為0分;若正確答案包括兩個選項,只選一個且正確的給2分,選兩個且都正確的給滿分,但只要選錯一個,該小題就為0分)
題號
10
11
12
13
14
15
16
17
18
答案
BD
C
B
C
C
CD
D
AD
AB
說明:非選擇題的化學方程式、離子方程式中,化學式錯、配平錯,給0分;“↑”“↓”符號、條件等錯漏扣一半分。
三、(本題包括3小題,共34分)
19.(10分)
(1) Cu2++ CO32-+H2O= Cu(OH)2 ↓+CO2↑
或CO32-+H2O HCO3-+OH-,Cu2++2OH‑=
Cu(OH)2 ↓ (2分)
HCO3-+OH-,Cu2++2OH‑=
Cu(OH)2 ↓ (2分)
(2)取最后一次洗滌液,滴加BaCl2溶液,無沉淀生成,說明已洗凈。(2分)
(3)CuSO4、澄清石灰水 (各1分,共2分)
(4)B中無水硫酸銅變藍,澄清石灰水不變渾濁(各1分,共2分)
(5) 實驗結束后裝置中殘留的氣體不能被吸收;裝置中原有的空氣有影響;石灰水可能會吸收空氣中的CO2。(2分,答任一點即可)
20.(12分)
(1)取少量濾液加入試管中,先滴加KSCN溶液(1分),再滴加氯水(或雙氧水、稀硝酸)(1分),溶液由淺綠色變為血紅色(1分)。 (共3分,合理即給分)
(2)將Fe2+全部氧化為Fe3+(1分)
(3)Fe3++3OH―=Fe(OH)3↓(或Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+) (2分)
(4)過濾、冷卻(各1分,共2分)
(5)①250mL容量瓶 (1分) ②b (1分)
(6) 69.5mg(2分)
21.(12分)
(l)假設2 :溶液中存在SO32―和HCO3―( 1分)
假設3、溶液中存在HCO3―和SO42―(2和3順序不限。)(1分)
(2)
步驟編號
實驗操作
預期現象和結論
①
用膠頭滴管取少量溶液加入試管A中,再用滴管取過量的lmol/L氯化鋇溶液并滴入其中(1分),充分反應,靜置,然后將沉淀和上層清液分別裝入另外的兩支試管B、C中(1分)
產生白色沉淀,說明原溶液中含有SO42―或SO32―或兩者都有(2分)
②
往裝有沉淀的試管B中加入過量的2mol/L鹽酸,將產生的氣體通入品紅溶液(1分)
沉淀部分溶解, 并產生氣體. (1分)
品紅褪色,說明原溶液中一定含有SO42―和SO32―(1分)
③
往裝有上層清液的試管C中加入2mol/L鹽酸;將產生的氣體通入澄清石灰水(1分)
產生無色氣泡, (1分)
澄清石灰水變渾濁,說明原溶液中含有HCO3―(1分)
④
其它方案合理給分
四、(本題包括3小題,共34分)
22.(11分)
(1) (2分)
C(NH3)(mol?L-1)
(2分)
C(NH3)(mol?L-1)
 (2)50% (2分)
(2)50% (2分)
(3)a、c (2分,答對1個1分,多選、選錯為0分)
(4)向正反應方向(1分);不變(1分)
(5)(3分)如右圖:
23.(11分)
(1)BaSO4(s)+4C(s)= BaS(s)+4CO(g);△H=+571.2 kJ•mol-1 (2分)
(2)S2-
+ H2O  HS- + OH-(2分)
HS- + OH-(2分)
(3)解:設每次用1.00L 2.0 mol•L-1飽和Na2CO3溶液能處理xmol BaSO4
BaSO4+CO32-=BaCO3+SO42-
(2.0-x) mol•L-1 x mol•L-1
|