
題目列表(包括答案和解析)
| ①鎂、鋁、鋅都是銀白色的金屬 ②鋅(Zn)可以與NaOH溶液反應生成H2 ③Zn(OH)2為白色固體,難溶于水,可溶于強堿及NH3?H2O ④Zn2+易形成絡合物如[Zn(NH3)4]2+,該絡合物遇強酸分解生成Zn2+、NH4+●提出假設: (1)假設①:該混合金屬粉末中除鎂外還含有 Al Al 元素假設②:該混合金屬粉末中除鎂外還含有 Zn Zn 元素假設③:該混合金屬粉末中除鎂外還含有鋁、鋅元素 ●實驗探究: 甲同學基于假設③設計實驗方案如下:乙同學同樣基于假設③設計另一實驗方案如下: 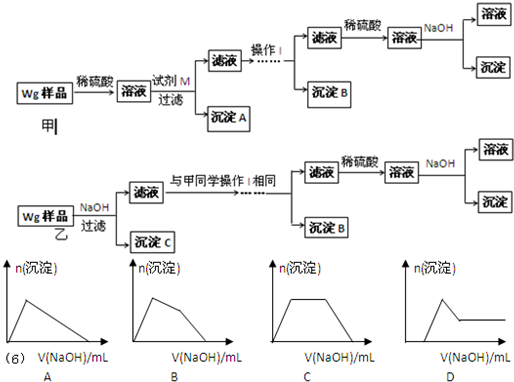 (2)試劑M是 NaOH溶液 NaOH溶液 ;沉淀B是Al(OH)3 Al(OH)3 .(3)丙同學認為乙同學的方案比甲同學的好,理由是 步驟簡單,節約試劑 步驟簡單,節約試劑 .(4)丁同學研究了甲、乙兩同學的方案后,在其中一種方案的基礎上用最簡便方法測定了Wg樣品中金屬鎂(Mg)的質量,他的方法是 將沉淀C洗滌、小心干燥后稱量 將沉淀C洗滌、小心干燥后稱量 .(5)操作Ⅰ的主要過程是:在濾液中逐滴加入 稀硫酸 稀硫酸 ,直至生成的沉淀剛好溶解,再加入足量的稀氨水 稀氨水 .(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等離子,向其中逐滴加入NaOH溶液,則生成沉淀的物質的量與加入NaOH溶液體積關系的圖象正確的是 B B .
鈉、鎂、鋁是重要的金屬元素,與我們的生活和生產關系密切。 (1)元素的性質特別是化學性質取決于元素原子結構。鈉離子的電子排布式為_______,鋁元素的原子結構示意圖為_________。 (2)鈉、鎂、鋁元素的陽離子半徑由小到大的順序是_____________(用離子符號表示)。在短周期中非金屬性最強的元素位于第____周期____族。 (3)鈉、鎂、鋁的單質及其化合物在某些性質上存在著遞變規律。下列有關說法正確的是___________(選填編號)。 a.三種元素的金屬性越強,金屬單質的熔點就越高 b.其堿性按NaOH、Mg(OH)2、Al(OH)3順序依次減弱 c.常溫下都能與濃硝酸劇烈反應生成硝酸鹽,但劇烈程度依次減弱 d.等質量的鈉、鎂、鋁與足量稀硫酸反應生成氫氣的物質的量依次增加 (4)1932年,美國化學大師Linus Pauling提出電負性(用希臘字母χ表示)的概念,用來確定化合物中原子某種能力的相對大小。Linus Pauling假定氟元素的電負性為4,并通過熱化學方法建立了其他元素的電負性。第三周期主族元素的電負性如下:
從上表可以看出電負性的大小與元素非金屬性的強弱關系是____________________;大量事實表明,當兩種元素的χ值相差大于或等于1.7時,形成的化合物一般是離子化合物,根據此經驗規律,AlBr3中的化學鍵類型應該是 。 (8分)鈉、鎂、鋁是重要的金屬元素,與我們的生活和生產關系密切。 (1)元素的性質特別是化學性質取決于元素原子結構。鈉離子的電子排布式為_______,鋁元素的原子結構示意圖為_________。 (2)鈉、鎂、鋁元素的陽離子半徑由小到大的順序是_____________(用離子符號表示)。在短周期中非金屬性最強的元素位于第____周期____族。 (3)鈉、鎂、鋁的單質及其化合物在某些性質上存在著遞變規律。下列有關說法正確的是___________(選填編號)。 a.三種元素的金屬性越強,金屬單質的熔點就越高 b.其堿性按NaOH、Mg(OH)2、Al(OH)3順序依次減弱 c.常溫下都能與濃硝酸劇烈反應生成硝酸鹽,但劇烈程度依次減弱 d.等質量的鈉、鎂、鋁與足量稀硫酸反應生成氫氣的物質的量依次增加 (4)1932年,美國化學大師Linus Pauling提出電負性(用希臘字母χ表示)的概念,用來確定化合物中原子某種能力的相對大小。LinusPauling假定氟元素的電負性為4,并通過熱化學方法建立了其他元素的電負性。第三周期主族元素的電負性如下:
從上表可以看出電負性的大小與元素非金屬性的強弱關系是____________________;大量事實表明,當兩種元素的χ值相差大于或等于1.7時,形成的化合物一般是離子化合物,根據此經驗規律,AlBr3中的化學鍵類型應該是 。
(8分)鈉、鎂、鋁是重要的金屬元素,與我們的生活和生產關系密切。
(8分)鈉、鎂、鋁是重要的金屬元素,與我們的生活和生產關系密切。 (1)元素的性質特別是化學性質取決于元素原子結構。鈉離子的電子排布式為_______,鋁元素的原子結構示意圖為_________。 (2)鈉、鎂、鋁元素的陽離子半徑由小到大的順序是_____________(用離子符號表示)。在短周期中非金屬性最強的元素位于第____周期____族。 (3)鈉、鎂、鋁的單質及其化合物在某些性質上存在著遞變規律。下列有關說法正確的是___________(選填編號)。 a.三種元素的金屬性越強,金屬單質的熔點就越高 b.其堿性按NaOH、Mg(OH)2、Al(OH)3順序依次減弱 c.常溫下都能與濃硝酸劇烈反應生成硝酸鹽,但劇烈程度依次減弱 d.等質量的鈉、鎂、鋁與足量稀硫酸反應生成氫氣的物質的量依次增加 (4)1932年,美國化學大師Linus Pauling提出電負性(用希臘字母χ表示)的概念,用來確定化合物中原子某種能力的相對大小。Linus Pauling假定氟元素的電負性為4,并通過熱化學方法建立了其他元素的電負性。第三周期主族元素的電負性如下:
從上表可以看出電負性的大小與元素非金屬性的強弱關系是____________________;大量事實表明,當兩種元素的χ值相差大于或等于1.7時,形成的化合物一般是離子化合物,根據此經驗規律,AlBr3中的化學鍵類型應該是 。
同步練習冊答案 湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區 違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com版權聲明:本站所有文章,圖片來源于網絡,著作權及版權歸原作者所有,轉載無意侵犯版權,如有侵權,請作者速來函告知,我們將盡快處理,聯系qq:3310059649。 ICP備案序號: 滬ICP備07509807號-10 鄂公網安備42018502000812號 |