
題目列表(包括答案和解析)
| |||||||||||||||||||
(1)實驗過程中發生的有關反應的離子方程式為:________。?
(2)由Ⅰ組數據直接推測:標準狀況下3.7 g樣品進行同樣實驗時,生成氨氣的體積為________L。
(3)試計算該混合物中的(NH4)2SO4和NH4HSO4物質的量之比________。?
(4)欲計算該NaOH溶液的物質的量濃度應選擇第________組數據,由此求得NaOH溶液的物質的量濃度為________。〔(2)~(3)小題只填結果,不必寫出計算過程,(4)小題必須寫出計算過程〕
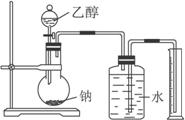
為確定其結構,應利用物質的特殊性質進行定性、定量實驗。現給出乙醇、鈉、水及必要的儀器,請甲、乙、丙、丁四名學生直接利用如圖給定的裝置開始進行實驗確定乙醇的結構。
(1)學生甲得到一組實驗數據:
乙醇的物質的量 | 氫氣的體積(標準狀況) |
0.10 mol |
根據以上數據推斷乙醇的結構應為___________,理由是____________________________。
(2)學生乙分別準確稱量
(3)學生丙認為實驗成功的關鍵有:①裝置氣密性良好;②實驗開始前準確測定乙醇的量;③鈉足量;④廣口瓶內必須充滿水;⑤氫氣體積的測算方法正確、數值準確。其中正確的有______________(填序號)。
(4)學生丁不想通過稱量乙醇的質量來確定乙醇的量,那么他還需要知道的數據是_____________________________________________________________________。
(5)實驗后四名學生從乙醇的可能結構分析入手對乙醇和鈉的量的關系進行討論,如果乙醇的物質的量為n mol,那么對鈉的物質的量的取值要求必須是______________。
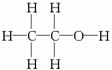
經測定乙醇的分子式是C2H6O。由于有機化合物普遍存在同分異構現象,推測乙醇結構可能是下列兩種之一:
(Ⅰ)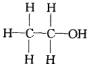 (Ⅱ)
(Ⅱ)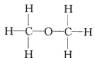
為確定其結構,應利用物質的特殊性質進行定性、定量實驗。現給出乙醇、鈉、水及必要的儀器,請甲、乙、丙、丁四名學生直接利用如圖給定的裝置開始進行實驗確定乙醇的結構。
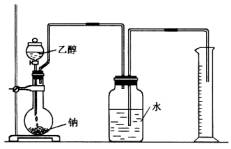
(1)學生甲得到一組實驗數據:
|
乙醇的物質的量 |
氫氣的體積(標準狀況) |
|
0.10mol |
1.12L |
根據以上數據推斷乙醇的結構應為________(用Ⅰ、Ⅱ表示),理由是___________。
(2)學生乙分別準確稱量4.60 g乙醇進行多次實驗,結果發現已排到量筒內的水的體積作為生成氫氣的體積換算成標準狀況后都小于1.12L。如果忽略量筒本身及讀數造成的誤差,那么學生乙認為是由于樣品乙醇中含有少量水造成的,你認為正確嗎?答:__________(填“正確”或“不正確”)。如果你認為正確,請說明理由;你認為不正確,那么產生這種情況的原因應是什么?答________
(3)學生丙認為實驗成功的關鍵有:①裝置氣密性良好;②實驗開始前準確確定乙醇的量;③鈉足量;④廣口瓶內必須充滿水;⑤氫氣體積的測算方法正確、數值準確。其中正確的有__________(填序號)。
(4)學生丁不想通過稱量乙醇的質量來確定乙醇的量,那么他還需要知道的數據是__________。
(5)實驗后四名學生從乙醇的可能結構分析人手對乙醇和鈉的量的關系進行討論,如果乙醇的物質的量為nmol,那么對鈉的物質的量的取值要求必須是__________。
(Ⅰ)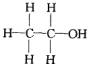 (Ⅱ)
(Ⅱ)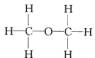
為確定其結構,應利用物質的特殊性質進行定性、定量實驗。現給出乙醇、鈉、水及必要的儀器,請甲、乙、丙、丁四名學生直接利用如圖給定的裝置開始進行實驗確定乙醇的結構。
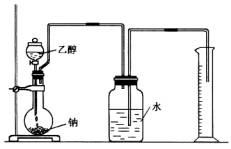
(1)學生甲得到一組實驗數據:
|
乙醇的物質的量 |
氫氣的體積(標準狀況) |
|
0.10mol |
1.12L |
根據以上數據推斷乙醇的結構應為________(用Ⅰ、Ⅱ表示),理由是___________。
(2)學生乙分別準確稱量4.60 g乙醇進行多次實驗,結果發現已排到量筒內的水的體積作為生成氫氣的體積換算成標準狀況后都小于1.12L。如果忽略量筒本身及讀數造成的誤差,那么學生乙認為是由于樣品乙醇中含有少量水造成的,你認為正確嗎?答:__________(填“正確”或“不正確”)。如果你認為正確,請說明理由;你認為不正確,那么產生這種情況的原因應是什么?答________
(3)學生丙認為實驗成功的關鍵有:①裝置氣密性良好;②實驗開始前準確確定乙醇的量;③鈉足量;④廣口瓶內必須充滿水;⑤氫氣體積的測算方法正確、數值準確。其中正確的有__________(填序號)。
(4)學生丁不想通過稱量乙醇的質量來確定乙醇的量,那么他還需要知道的數據是__________。
(5)實驗后四名學生從乙醇的可能結構分析人手對乙醇和鈉的量的關系進行討論,如果乙醇的物質的量為nmol,那么對鈉的物質的量的取值要求必須是__________。
1.B 2.A 3.D 4.D 5.B 6.C 7.A 8.C 9.D 10.A
11.A 12.C 13.A 14.D 15.B 16.D 17.A
18.(8分)(1)碳(1分) (2)  (1分) (3)Cl->O2->Na+ (2分)
(1分) (3)Cl->O2->Na+ (2分)
(4)離子鍵和共價鍵(2分)(說明:可不答配位鍵)
(5)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(2分)
NH3↑+CO32-+2H2O(2分)
19.(6分)(1) NaHSO4、NaAlO2 (3分) (2) BaCl2、MgCl2、NaHCO3(3分)
20. (6分)(1)剛開始時溶液變為藍色,隨著氯水的繼續加入,溶液的藍色褪去,最終變為淺黃綠色。(2分)
(2)Cl2 + 2I- = 2Cl- + I2 (2分) 5Cl2 + I2 + 6H2O = 10Cl- +2IO3- + 12H+ (2分)
(說明:第2個離子方程式可不配平)
21.(8分)(1)催化(1分) 氧化(1分)
(2)KClO3(1分) H2O2(1分)
(3)MnO2+4HCl(濃) MnCl2+C12↑+2H2O(2分)
MnCl2+C12↑+2H2O(2分)
(4)Fe3O4+8H+ = Fe2++2 Fe3++ 4H2O(2分)
22.(12分)(1)① b c a c d(2分)
吸收未反應的NH3,防止空氣中的水蒸氣進入(第二個c 裝置中)(2分)
②2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O(2分)
2NH3↑+CaCl2+2H2O(2分)
③ -16 (2分) ④AC (2分)
-16 (2分) ④AC (2分)
(2) AC (2分)
23.(9分)(1)H++OH―=H2O(1分)
NH4++OH― NH3↑+H2O(1分)
NH3↑+H2O(1分)
(2)0.84(2分) (3)1:4 (2分)
(4)Ⅲ(1分) 5 mol?L-1 (2分)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com