
題目列表(包括答案和解析)
金屬材料在生產(chǎn)、生活中有著廣泛的應用.
(1)下列應用中使用金屬材料的有________,使用有機合成材料的有________(填字母).

(2)化學小組為了驗證鐵、銅、鎂、汞的金屬活動性順序,設計了如下實驗方案:
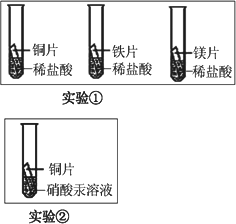
根據(jù)實驗①判斷出鎂的金屬活動性比鐵強,依據(jù)的現(xiàn)象是________;
根據(jù)實驗②的現(xiàn)象得出的結(jié)論是________.
(3)化學小組收集到洗照片用過的硝酸銀廢液,利用廢鐵、廢鋅回收金屬銀.他們將金屬混合物加入到硝酸銀廢液中,充分反應后過濾,得到固體和淺綠色溶液(忽略其他雜質(zhì)),為了探究濾液中溶質(zhì)的可能組成,他們做出以下猜想:
①溶質(zhì)為硝酸鋅
②溶質(zhì)為硝酸亞鐵和硝酸銀
③溶質(zhì)為硝酸鋅、硝酸亞鐵
④溶質(zhì)為硝酸鋅、硝酸亞鐵、硝酸銀
上述猜想中可能正確的是________.
(4)小組同學繼續(xù)實驗驗證所得銀粉固體中是否含有鐵粉:
甲同學用簡單的物理方法證明了固體中含有鐵粉.他的方法是________,乙同學設計了如下測定固體中含銀的質(zhì)量分數(shù)的實驗步驟:
A.取兩藥匙樣品,加入過量稀硫酸;
B.待充分反應后,取出不溶物;
C.不溶物經(jīng)洗滌、干燥后稱量,記錄其質(zhì)量.
請回答:①步驟B中判斷已充分反應的依據(jù)是________;
②乙同學設計的實驗方案能否達到實驗目的,請說明理由________,________.
顆粒達到納米級的單質(zhì)鐵具有很強的反應活性,俗稱“納米鐵”.實驗室制備的方法是:以高純氮氣作保護氣,在高溫條件下用H2和FeCl2發(fā)生置換反應,生成“納米鐵”.請回答以下問題:
(1)寫出生成“納米鐵”的化學方程式________.
(2)反應中需要保護氣的原因是________.
(3)某化學探究小組為了驗證鐵、銅、鎂、汞的金屬活動性順序,設計了如下實驗方案:①將大小一樣的鐵片和鎂片分別加入到溶質(zhì)質(zhì)量分數(shù)相同的稀鹽酸中;②將銅片加入到硝酸汞溶液中,銅片上出現(xiàn)銀白色物質(zhì);③將金屬片A加入到溶液B中.根據(jù)實驗①判斷出鎂的金屬活動性比鐵強,依據(jù)的現(xiàn)象是________;根據(jù)實驗②的現(xiàn)象得出的結(jié)論是________;要通過實驗③得出鐵和銅的金屬活動性順序,那么,如果B是硫酸銅溶液,則金屬A是________,如果A是銅,則溶液B是________.
顆粒達到納米級的單質(zhì)鐵具有很強的反應活性,俗稱“納米鐵”.實驗室制備的方法是:以高純氮氣作保護氣,在高溫條件下用H2和FeCl2發(fā)生置換反應,生成“納米鐵”.請回答以下問題:
(1)寫出生成“納米鐵”的化學方程式________.
(2)反應中需要保護氣的原因是________.
(3)某化學探究小組為了驗證鐵、銅、鎂、汞的金屬活動性順序,設計了如下實驗方案:①將大小一樣的鐵片和鎂片分別加入到溶質(zhì)質(zhì)量分數(shù)相同的稀鹽酸中;②將銅片加入到硝酸汞溶液中,銅片上出現(xiàn)銀白色物質(zhì);③將金屬片A加入到溶液B中.根據(jù)實驗①判斷出鎂的金屬活動性比鐵強,依據(jù)的現(xiàn)象是________;根據(jù)實驗②的現(xiàn)象得出的結(jié)論是________;要通過實驗③得出鐵和銅的金屬活動性順序,那么,如果B是硫酸銅溶液,則金屬A是________,如果A是銅,則溶液B是________.
顆粒達到納米級的單質(zhì)鐵具有很強的反應活性,俗稱撃擅滋鷶。實驗室制備的方法是:以高純氮氣作保護氣,在高溫條件下用H2和FeCl2發(fā)生置換反應,生成撃擅滋鷶。請回答以下問題:
(1)寫出生成撃擅滋鷶?shù)幕瘜W方程式 ______________。
(2)反應中需要保護氣的原因是 。
(3)某化學探究小組為了驗證鐵、銅、鎂、汞的金屬活動性順序,設計了如下實驗方案:①將大小一樣的鐵片和鎂片分別加入到溶質(zhì)質(zhì)量分數(shù)相同的稀鹽酸中;②將銅片加入到硝酸汞溶液中,銅片上出現(xiàn)銀白色物質(zhì);③將金屬片A加入到溶液B中。根據(jù)實驗①判斷出鎂的金屬活動性比鐵強,依據(jù)的現(xiàn)象是 ;根據(jù)實驗②的現(xiàn)象得出的結(jié)論是 ;要通過實驗③得出鐵和銅的金屬活動性順序,那么,如果B是硫酸銅溶液,則金屬A是 ,如果A是銅,則溶液B是 。
一、選擇題(本大題有14小題,1~8題每小題2分,9~14題每小題3分,共34分)
題號
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
B
C
A
D
B
D
A
B
D
C
D
D
B
二、填空題(本大題有5小題,共24分)(以下除化學方程式2分外,其余每空1分)。
15.(4分) (1)E (2)A (3)D (4)B。
16.(3分)(1)硝酸見光易分解。
(2)高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image044.gif) ; 質(zhì)量守恒定律,反應前后原子的種類和數(shù)目不變。
; 質(zhì)量守恒定律,反應前后原子的種類和數(shù)目不變。
17.(7分)(1)19.00 , 20 。 (2)8; (3)BC (4)B;
(5)高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image048.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image050.gif) +2
+2高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image052.gif) 。
。
18.(4分)鎂片與鹽酸反應比鐵片與鹽酸反應劇烈。
銅的金屬活動性比汞強(或Cu>Hg); 鐵(Fe); 鹽酸(或氯化亞鐵)等。
19.(6分)(1)導熱性 (2)①2C4H10+13O2點燃8CO2+10H2O
②物理 ③方便添加燃料;便于灰渣的排出;有利于空氣的流通(任答1點)
(3)使熄滅的外部火焰的氣體的溫度達到著火點
三、綜合能力題 (本題有2小題,共18分)
20.(9分)(1)A、B、C分別為:NaOH、CuCl2、Na2CO3 或 NaOH、HNO3、Fe2O3
【說明:B物質(zhì)對得1分,A與B、HCl全對得1分,C與B、HCl全對得1分;若B
物質(zhì)錯則不得分。填物質(zhì)名稱不得分。本題屬開放性答案,其它合理答案也可】
(2)化學方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaOH+HCl==NaCl+H2O
[或2NaOH+CuCl2==Cu(OH)2↓+2NaCl或Na2CO3+CuCl2==CuCO3↓+2NaCl等]
【說明:所寫化學方程式要與A、B、C三空對應,只有得分的物質(zhì),該化學方程式才能得分,否則不給分】
(3)酸與堿反應生成鹽和水; 酸與鹽反應生成新酸和新鹽;(其它合理答案都給分)
21.(9分)(1)硫酸鋅(1分); Fe(1分)。
(2)高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image054.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image056.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image058.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image060.gif) (或
(或高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image054.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image063.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image058.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image066.gif) )(2分)
)(2分)
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image054.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image069.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image058.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image071.gif) ↑(2分)
↑(2分)
(3)取步驟④的濾渣于試管中加入少量稀硫酸,若有氣泡產(chǎn)生則酸不足量。(1分)
(4)硫酸鋅的質(zhì)量、鋅粉的質(zhì)量。(2分)
四、實驗與探究題(本題有2小題,共27分)
22.(化學方程式2分,共14分)
(1)①錐形瓶,②酒精燈;(2分)
(2)B, 2KMnO4高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image073.gif) K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3) 2Na2O2 + 2H2O = 4NaOH + O2↑ 2CaO2 + 2H2O = 2Ca(OH)2 + O2↑
g→f→i(對兩個得1分,對三個得2分) CO2;(1分)
(4) 藥品的狀態(tài)和反應條件;(1分)
(5) 可隨時加液體反應物,并通過滴加液體的快慢,控制反應的速率(1分)。
23.(13分)(1)(以下除化學方程式2分外,其余每空1分)。
白色粉末的成分
形成的原因
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image076.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image078.gif) ↓+
↓+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image052.gif)
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif)
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image078.gif) 和
和高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif) 的混合物
的混合物
(2)高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif) 微溶于水(或可能是氫氧化鈣)
微溶于水(或可能是氫氧化鈣)
實驗步驟
可能觀察到的現(xiàn)象
結(jié)論
酚酞試液變紅色
白色粉末中有高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif)
有氣泡產(chǎn)生
有
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image078.gif) 和
和高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif) 的混合物
的混合物
或
實驗步驟
可能觀察到的現(xiàn)象
結(jié)論
酚酞試液變紅色
白色粉末中有高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif)
無氣泡產(chǎn)生
無
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif)
或
實驗步驟
可能觀察到的現(xiàn)象
結(jié)論
酚酞試液不變色
白色粉末中無高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif)
有氣泡產(chǎn)生
有
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image078.gif)
(3)交流與反思
①A和B(多選一個或漏選一個都不給分)
②高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image078.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image082.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image084.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image052.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image076.gif) ↑(或
↑(或高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image046.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image082.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image084.gif) +
+高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image088.gif) )
)
五、計算題(本題有2小題,共17分)
24.(7分)(1)③(1分); (2) ①396 (2分),② 84∶11∶4 (2分) (3) 50% (2分)
25.(10分)(1)4.4(2分)
(2)高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image038.gif) 、
、高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image091.gif) (2分,答對一個給1分,有錯項不給分)
(2分,答對一個給1分,有錯項不給分)
(3)解:73g10%的稀鹽酸中含HCl的質(zhì)量是:73g×10%=7.3g
設參加反應的碳酸鈉的質(zhì)量為x,反應生成的氯化鈉的質(zhì)量為y。
Na2CO3 +2HCl = 2NaCl +CO2↑ +H2O (1分)
106 73 117
x 7.3g y
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image093.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image095.gif) x=10.6g
(1分)
x=10.6g
(1分)
高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image097.gif) =
=高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image099.gif) y=11.7g
(1分)
y=11.7g
(1分)
燒杯里不飽和溶液中溶質(zhì)的質(zhì)量為:11.7g+(22.3g-10.6g)=23.4g (1分)
燒杯里不飽和溶液質(zhì)量為: 22.3g+73g-4.4g=90.9g (1分)
燒杯里不飽和溶液中溶質(zhì)的質(zhì)量分數(shù)為:高中階段學校招生與初中畢業(yè)生學業(yè)模擬試卷―化學.files/image101.gif) ×100%=25.7% (1分)
×100%=25.7% (1分)
答:略
本資料由《七彩教育網(wǎng)》www.7caiedu.cn 提供!
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com