
題目列表(包括答案和解析)
 反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如圖所示,回答下列問題:
反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如圖所示,回答下列問題:
| |||||||||||||||||||||||||||||||
(1)將水蒸氣通過紅熱的碳即可產生水煤氣。反應為:
![]()
![]() ;ΔH=+131.3 kJ•mol-1(吸熱)
;ΔH=+131.3 kJ•mol-1(吸熱)
![]() 一定溫度下,在一個容積可變的密閉容器中,發生上述反應,下列能判斷該反應達到化學平衡狀態的是 (填字母序號)
一定溫度下,在一個容積可變的密閉容器中,發生上述反應,下列能判斷該反應達到化學平衡狀態的是 (填字母序號)
![]() a.容器中的壓強不變 b.1 mol H―H鍵斷裂的同時斷裂2 molH―O鍵
a.容器中的壓強不變 b.1 mol H―H鍵斷裂的同時斷裂2 molH―O鍵
![]() c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
![]() (2)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進行反應
(2)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進行反應
![]()
![]() ,得到如下三組數據:
,得到如下三組數據:
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所
| ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①實驗1中以v(CO2) 表示的反應速率為 。
![]() ②該反應的逆反應為 (填“吸”或“放”)熱反應
②該反應的逆反應為 (填“吸”或“放”)熱反應
![]() ③若實驗3要達到與實驗2相同的平衡狀態(即各物質的質量分數分別相等),且t<3min,則a、b應滿足的關系是 (用含a、b的數學式表示)。
③若實驗3要達到與實驗2相同的平衡狀態(即各物質的質量分數分別相等),且t<3min,則a、b應滿足的關系是 (用含a、b的數學式表示)。
(1)在一定條件下,容積為 10 L密閉容器中發生反應:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
將1.0 mol CH4和2.0 mol H2O(g)通入該密閉容器 3 s時有0.1 mol CO生成,則3 s內該反應的平均速率v(H2)= 。
(2)在壓強為0.1 MPa條件下,容積為V L某密閉容器中a mol CO與 2a mol H2在催化劑作用下反應生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。CO的轉化率與溫度、壓強的關系如圖。
CH3OH(g)。CO的轉化率與溫度、壓強的關系如圖。
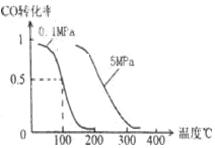
①該反應是 反應(填“放熱”或“吸熱”)。
②150℃時該反應的平衡常數K V2/a2(填“=”“<”或“>”)。
③在溫度容積不變的情況下,向該密閉容器再增加a mol CO與 2a mol H2,和b mol CH3OH(g),則達到新平衡時,CO的轉化率 (填“增大”、“減小”或“不變”或“無法確定”),平衡常數 (填“增大”、“減小”或“不變”)。
 △H=-272.0KJ?mo1-1
△H=-272.0KJ?mo1-1 △H=-1675.7KJ?mo1-1
△H=-1675.7KJ?mo1-1
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com