
 △H=-272.0KJ?mo1-1
△H=-272.0KJ?mo1-1 △H=-1675.7KJ?mo1-1
△H=-1675.7KJ?mo1-1
 O2(g)=FeO(s)△H=-272.0kJ?mol-1
O2(g)=FeO(s)△H=-272.0kJ?mol-1 O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1 ;
;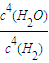 ;增大;
;增大;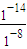 =10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水電離出的氫氧根離子濃度,即c(H+)=c水電離(OH-)=
=10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水電離出的氫氧根離子濃度,即c(H+)=c水電離(OH-)=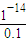 =10-13 mol/L,所以混合液中由水電離出的OH-濃度與0.1mol?L-1NaOH溶液中由水電離出的OH-濃度之比=10-6 mol/L:10-13 mol/L=107:1,
=10-13 mol/L,所以混合液中由水電離出的OH-濃度與0.1mol?L-1NaOH溶液中由水電離出的OH-濃度之比=10-6 mol/L:10-13 mol/L=107:1,

科目:高中化學 來源: 題型:閱讀理解
| 1 |
| 2 |
| 3 |
| 2 |

| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 元素性質 | 元素編號 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合價 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合價 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
| 催化劑 |
| 加熱 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年天津市河西區高三總復習質量檢測(二)理綜化學試卷(解析版) 題型:填空題
某芳香族化合物A在一定條件下能發生如下圖轉化,部分產物已略去。氣體F對
氫氣的相對密度為22。

請按要求回答下列問題:
(1)E的分子式是_____________;B的結構式為_____________;C的含氧官能團有(寫名稱)
_____________;反應⑦的反應類型是_____________。
(2)設計反應①、⑥的目的是____________________________________________。
(3)寫出下列反應的化學方程式:
反應④:_________________________________________________________________;
反應⑤:_________________________________________________________________。
(4)A的結構簡式是_______________________________________。
(5)己知有機物H比C的分子少一個CH2,且H具有如下性質:①遇FeCl3溶液發生顯色反應;②一
定條件下能發生水解反應;③分子中苯環上僅有兩個相鄰取代基。則H同分異構體的數目為_________;
其結構簡式之一為____________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年廣東省湛江市高三上學期普通高考測試(一)理綜化學試卷(解析版) 題型:計算題
工業上以氨氣為原料(鉑銠合金網為催化劑)催化氧化法制硝酸的過程如下:
|


 (1)己知反應一經發生,鉑銠合金網就會處于紅熱狀態。寫出氨催化氧化的化學方程式:______________________________________________;當溫度升高時,該反應的平衡常數K值___________(填“增大”、“減小”或“不變”)。
(1)己知反應一經發生,鉑銠合金網就會處于紅熱狀態。寫出氨催化氧化的化學方程式:______________________________________________;當溫度升高時,該反應的平衡常數K值___________(填“增大”、“減小”或“不變”)。
(2)硝酸廠尾氣常用的處理方法是催化還原法:催化劑存在時用H2將NO2還原為N2 。已知:
2H2(g)+O2(g)=2H2O(g) △H= a kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H= b kJ·mol-1
H2O(1)=H2O(g) △H= c kJ·mol-1
則反應2NO2(g)+4H2(g)=N2(g)+4H2O(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反應的化學方程式為N2+3H2 2NH3,該反應在固定容積的密閉容器中進行。下列各項標志著該反應達到化學平衡狀態的是____________(填序號)
2NH3,該反應在固定容積的密閉容器中進行。下列各項標志著該反應達到化學平衡狀態的是____________(填序號)
A.容器內N2、H2、NH3的濃度之比為1∶3∶2
B.3v正(N2)=v逆(H2)
C.容器內壓強保持不變
D.混合氣體的相對分子質量保持不變
E.1mol N≡N鍵斷裂,同時1mol H—H鍵斷裂
②若在恒溫條件下,將N2與H2按一定比例混合通入一個容積為2L的密閉容器中,5min反應達平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,則反應速率v(N2)=________________,H2的平衡轉化率=_________________;若保持容器的溫度不變,在10min時將容器的容積壓縮為lL,請在答題卡坐標圖中,畫出從反應開始至15min時c(NH3)隨時間變化曲線示意圖。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com