
題目列表(包括答案和解析)
2.過濾過程中若發現濾液渾濁,可檢查濾紙是否破損、燒杯是否洗干凈、過濾時液面是否低于濾紙的邊緣等。
3.氯化鈉在自然界的存在
海水、鹽湖、鹽井和鹽礦中都蘊藏著氯化鈉。用海水曬鹽或用井水、鹽湖水煮鹽,都可以使水分蒸發,使食鹽溶液得到飽和,再繼續蒸發就可以析出食鹽晶體,這樣得到的食鹽含有較多雜質,叫做粗鹽。要想得到純凈的食鹽,需要提純。
活動與探究:
實驗原理:將粗鹽溶解,過濾除去不溶物,再將濾液蒸發結晶。
實驗儀器:量筒、托盤天平、小燒杯、藥匙、膠頭滴管、玻璃棒、酒精燈、鐵架臺、蒸發皿、濾紙。
實驗藥品:蒸餾水、粗鹽。
實驗裝置:如下圖。

實驗過程:
|
步驟 |
現象 |
結論 |
|
(1)溶解:量取10 mL蒸餾水倒入燒杯,用天平稱取5.0 g粗鹽加入燒杯中,充分攪拌 |
燒杯中得到渾濁的液體 |
通過溶解、過濾、 蒸發等操作,可 除去粗鹽中不溶性雜質 |
|
(2)過濾:制作好過濾器,將燒杯中渾濁的液體沿著玻璃棒慢慢倒入漏斗 |
濾液變澄清, 濾紙上有大量泥沙等 |
|
|
(3)蒸發:將濾液倒入蒸發皿中,用酒精燈加熱,并不斷用玻璃棒攪拌,當出現多量固體時停止加熱,利用余熱把食鹽烘干 |
蒸發皿中出現大 量白色物質 |
|
|
(4)計算產率:用玻璃棒把固體轉移到紙上,稱量后,倒入指定容器,計算產率 |
所得食鹽的質量 比粗鹽少 |
實驗說明:1.過濾操作的要點是一貼、二低、三靠。
一貼:濾紙要緊貼在漏斗內壁上,中間不要留有氣泡;
二低:液面低于濾紙邊緣,濾紙邊緣低于漏斗邊緣;
三靠:玻璃棒要緊靠漏斗中三層濾紙處,盛混合液的燒杯口要緊靠在玻璃棒上,漏斗的末端要緊靠在盛接濾液的燒杯內壁上。
2.氯化鈉的用途
(1)醫療上用氯化鈉配制生理鹽水(質量分數為0.9%)。
(2)農業上用一定質量分數的氯化鈉溶液來選種。
(3)工業上用氯化鈉原料制取化工產品。
(4)生活中用于腌制食品等。
(5)用于使公路上的積雪融化。
(6)是重要的調味品,被稱為調味劑(調味品之王)。
(7)是化工原料等。
狀元筆記
醫生給病人注射生理鹽水,目的就是補充Na+和Cl-,以維持人體的正常生理活動。
1.氯化鈉對人體的作用
食鹽的主要成分是氯化鈉。氯化鈉是白色固體,易溶于水,其水溶液呈中性(pH=7)。氯化鈉在水溶液中電離出的Na+和Cl-對人體的正常生命活動起著重要的調節作用。Na+對維持細胞內外正常的水分分布和促進細胞內外物質交換起著主要作用;Cl-是胃液中的主要成分,具有促生鹽酸、幫助消化和增進食欲的作用。所以,人們每天都要攝入一些食鹽,但長期食用過多食鹽也不利于人體健康。
探究:由于核外電子的排布知識同學們了解不多,因此對于離子的形成、離子所帶電荷理解起來有一定難度。認識離子的有關知識,應從以下幾個方面入手:(1)離子的形成是原子得到或失去電子的產物。原子得到電子,自身帶上負電荷,形成陰離子;失去電子,帶上正電荷,形成陽離子,所以離子是帶電的原子;(2)離子是構成物質的一種微粒。同種電荷相互排斥,異種電荷相互吸引,陽離子和陰離子之間既相互吸引又相互排斥(核與核之間、電子與電子之間相互排斥),正是由于這種“相互作用”,才構成了物質。如氯化鈉(俗稱食鹽)就是由鈉離子和氯離子構成的;(3)離子得到或失去電子后可重新變成原子。
[例題2]填寫下圖中的空白。

解析:鎂原子質子數為12,最外層有2個電子,在化學反應中易失去最外層的2個電子,形成帶2個單位正電荷的陽離子,離子符號為Mg2+。
答案:(1)Mg (2)2 (3)失 (4)Mg2+(5)MgCl2
綠色通道:本題主要考查了離子的形成。元素的化學性質由最外層電子數決定,最外層電子得失后形成離子,得失電子的數值即為離子所帶電荷數。
針對訓練:
3.下列關于原子、分子和離子的敘述中正確的是( )
A.原子是不能再分的最小粒子
B.分子是可分的,它是能保持物質化學性質的唯一粒子
C.原子失去電子,形成的離子一定是陽離子
D.非金屬原子在化學反應中一定獲得電子,變為陰離子
答案:C 解析:原子由原子核和核外電子構成(在化學變化中,原子不可分),故A錯;由原子構成的物質,原子也能保持物質的化學性質,故B錯;原子失去電子,質子數大于電子數,帶正電荷,為陽離子,故C正確;非金屬原子在化學反應中也可以失去電子,形成陽離子,故D錯。
2.據《自然》雜志報道,科學家最近研制的一種以鍶原子做鐘擺的鐘是世界上最精確的鐘。鍶元素(元素符號為Sr)原子結構示意圖為: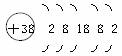 ?
?
鍶元素屬于________________(填“金屬”或“非金屬”)元素,鍶原子的核內質子數為________________,原子核外有________________個電子層,鍶離子的符號為_____________。
解析:根據鍶元素的原子結構示意圖,該原子的質子數為38(圈內數值),原子核外有5個電子層,最外層電子數為2,在化學變化中易失去2個電子,形成陽離子,離子符號為Sr2+,鍶元素屬于金屬元素。
答案:金屬 38 5 Sr2+
探究:原子中的電子繞核高速運轉,電子按能量的大小分層排布,能量小的在離核較近的電子層上運動,能量較高的在離核較遠的電子層上運動,先排第一層再排第二層,以此類推,第一層上最多排2個電子,第二層最多排8個電子,最外層最多排8個電子。原子中電子的排布通常用原子結構示意圖表示。如:
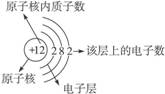
分析原子結構示意圖獲得的信息是:(1)金屬原子易失電子;(2)非金屬原子易得電子;(3)稀有氣體原子不易得電子,也不易失電子;(4)原子的化學性質是由原子的最外層電子數決定的。
[例題1]現有三種粒子結構示意圖: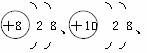
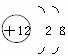 ,下列有關說法中正確的是( )
,下列有關說法中正確的是( )
A.它們表示同一種元素 B.它們都是具有相對穩定結構的原子
C.它們都帶有電荷 D.它們的核外電子數相同
解析:本題主要考查原子結構示意圖表示的意義。在化學上,質子數決定元素的種類,質子數相同的原子和離子屬于同種元素。把粒子最外層有8個電子的結構(只有一個電子層的最外層為2個電子)稱為穩定結構,具有相對穩定結構的粒子可能是原子也可能是離子。可根據粒子結構示意圖中粒子的質子數與核外電子數的關系來確定粒子是原子、陽離子或陰離子,即在結構示意圖中,質子數=核外電子數,該粒子是原子;質子數>核外電子數,該粒子是陽離子;質子數<核外電子數,該粒子是陰離子。核外電子數相等的粒子可能是不同元素的原子與離子或離子與離子。所以本題選D。
答案:D
黑色陷阱:本題常出現的錯誤有:一是認為粒子的核外電子數相同就是同種原子,從而導致錯選A;二是錯誤地認為8電子的相對穩定結構都是由原子通過得失電子形成的,原子就應帶有電荷,從而導致錯選C。
針對訓練:
1.某元素的原子結構示意圖為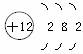 。小紅對它的認識中錯誤的是( )
。小紅對它的認識中錯誤的是( )
A.原子核內有12個質子 B.原子核外有3個電子層
C.該元素屬于金屬元素 D.該原子失去電子后帶負電荷
答案:D 解析:由原子結構示意圖可知,原子核內質子數為12,核外有3個電子層,最外層電子數為2,該元素屬于金屬元素,A、B、C正確;原子失去電子后帶正電荷,D錯誤。
3.答案:陽離子(Na+) 氯的陰離子(Cl-) 相互作用
師生互動
2.答案:右上方 數值 正負號
1.答案:帶電荷的原子(或原子團) 正電荷 負電荷
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com