11.
在恒溫條件下起始時容積均為5L的甲、乙兩密閉容器中(甲為恒容容器、乙為恒壓容器),均進行反應:N
2(g)+3H
2(g)?2NH
3(g)△H
2=-92.4kJ/mol,有關數據及特定平衡狀態見表.
| 容器 | 起始投入 | 達平衡時 |
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 |
(1)若平衡后同種物質的體積分數相同,起始時乙容器通入的N
2的物質的量為1.6mol,
起始時乙中的壓強是甲容器的0.8倍,乙的平衡常數為107(mol/L)
-2(2)恒容密閉容器中可以發生氨氣的分解反應,達平衡后,僅改變下表中反應條件x,下列各項中y隨x的增大而增大的是bc(選填序號).
| 選項 | a | b | c | d |
| x | 溫度 | 溫度 | 加入H2的物質的量 | 加入氨氣的物質的量 |
| y | 混合氣體的平均相對分子質量 | 平衡常數K | 混合氣體的密度 | 達平衡時氨氣的轉化率 |
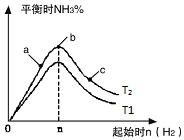
(3)研究在其他條件不變時,改變起始物氫氣的物質的量對反應的影響,實驗結果如圖所示(圖中T表示溫度,n表示物質的量):
①像中T
2和T
1的關系是:T
2低于T
1(填“高于”“低于”“等于”“無法確定”).
②a、b、c三點中,N
2轉化率最高的是c(填字母).
③若容器容積為1L,T
2℃在起始體系中加入1mol N
2,3molH
2,經過5min反應達到平衡時H
2的轉化率為60%,則NH
3的反應速率為0.24mol.L
-1.min
-1.保持容器體積不變,若起始時向容器內放入2mol N
2和6mol H
2,達平衡后放出的熱量為Q,則Q>110.88kJ(填“>”、“<”或“=”).

 ;
; ;
; ;
; 在恒溫條件下起始時容積均為5L的甲、乙兩密閉容器中(甲為恒容容器、乙為恒壓容器),均進行反應:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有關數據及特定平衡狀態見表.
在恒溫條件下起始時容積均為5L的甲、乙兩密閉容器中(甲為恒容容器、乙為恒壓容器),均進行反應:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有關數據及特定平衡狀態見表.