
科目: 來源: 題型:
現有苯酚的乙醇溶液,若用該溶液回收苯酚,可供選用的操作有①加適量鹽酸;②蒸餾;③過濾;④分液;⑤加足量的NaOH溶液;⑥加足量的FeCl3溶液;⑦加適量的乙醇和濃硫酸混合液;⑧加足量的濃溴水;⑨加熱;⑩通入過量的CO2。正確的操作步驟是 ( )
A、⑦⑨② B、⑧③①② C、⑥②①④ D、⑤②⑩④
查看答案和解析>>
科目: 來源: 題型:
運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義。
(1)氮是地球上含量豐富的元素,氮及其化合物在工農業生產、生活中有著重要作用。
①下圖是一定的溫度和壓強下是N2和H2反應生成1molNH3過程中能量變化示意圖,請寫出工業合成氨的熱化學反應方程式: 。(△H的數值用含字母a、b的代數式表示)

②氨氣溶于水得到氨水。在25°C下,將m mol·L-1的氨水與n mol·L-1的鹽酸等體積混合,反應后的溶液呈中性,則c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含m和n的代數式表示出混合液中氨水的電離平衡常數表達式 。
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合態存在。
25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入適量的0.1mol·L-1硝酸銀溶液,有白色沉淀生成。從沉淀溶解平衡的角度解釋產生沉淀的原因是 ,向反應后的濁液中,繼續加入適量0.1mol·L-1的NaI溶液,振蕩、靜置,看到的現象是 ,產生該現象的原因是(用離子方程式表示) 。
(已知25°C時![]() )
)
查看答案和解析>>
科目: 來源: 題型:
25 ℃時,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,混合溶液pH的變化曲線如圖所示,下列分析結論正確的是
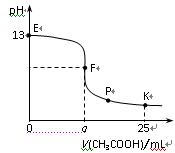
A.a=12.5,且混合溶液pH=7
B.對應曲線上E、F之間的任何一點,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.P點時,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.K點時,c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目: 來源: 題型:
下列敘述中正確的是( )
A、用玉米、植物秸稈等作原料制造乙醇,用作汽車的燃料
B、利用油脂在酸性條件下水解,可以生產甘油和肥皂
C、淀粉與纖維素分子式都為(C6H10O5)n而結構不同,所以它們互為同分異構體
D、1mol羥基含有電子數10NA
查看答案和解析>>
科目: 來源: 題型:
用下圖裝置可以進行測定SO2轉化成SO3的轉化率的實驗。已知SO3的熔點是16.8℃,沸點是445.8℃。已知發生裝置中所涉及反應的化學方程式為:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑
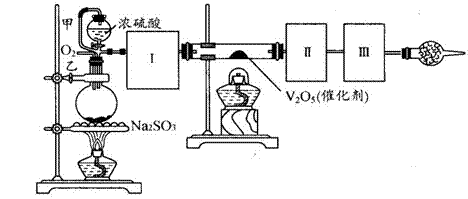
(1)根據實驗需要,應該在Ⅰ、Ⅱ、Ⅲ處連接合適的裝置。請從下圖A~E裝置中選擇最適合裝置并將其序號填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ處連接的裝置分別是_______________、_______________、_______________。

(2)從乙處均勻通入O2,為使SO2有較高的轉化率,實驗中在加熱催化劑與滴加濃硫酸的順序中,應采取的操作是 。
(3)將SO2通入含1.5mol氯酸的溶液中,可生成一種強酸和一種氧化物,若有1.5×6.02×1023個電子轉移時,該反應的化學方程式
(4)用amolNa2SO3粉末與足量濃硫酸進行此實驗,當反應結束時,繼續通入O2一段時間后,測得裝置Ⅲ增重了bg,則實驗中SO2的轉化率為 %(用含a、b的代數式填寫)
(5)尾端球形干燥管的作用是 。
查看答案和解析>>
科目: 來源: 題型:
下列實驗方案合理的是
A.檢驗混合離子溶液中的SO42-:加入HCl酸化的Ba(NO3)2溶液,觀察有無白色沉淀生成
B.除去NO中混有的少量NO2:將混合氣體通入水中,再用排空氣法收集NO
C.配制濃度為0.1mol/L的NaOH溶液:將0.05molNaOH溶于500mL水配成溶液
D.檢驗氯化鐵溶液中是否混有Cu2+:紙上層析后用氨熏
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com