
科目: 來源: 題型:
對于易燃、易爆、有毒的化學物質,往往會在其包裝上貼以下危險警告標簽。下面所列物質中,貼錯了標簽的是( )
| A | B | C | D | ||
| 物質的 化學式 | 濃HNO3 | CCl4 | KCN | KClO3 | |
| 危險警 告標簽 |
腐蝕性 |
易燃的 |
|
| |
查看答案和解析>>
科目: 來源: 題型:
下列實驗敘述不正確的是( )
A.從試劑瓶中取出并切下使用的鈉塊后,剩余的鈉不能放回原試劑瓶
B.過濾時,將燒杯尖嘴靠在玻璃棒上,將玻璃棒下端靠在三層濾紙上
C.蒸餾時,冷凝水應從冷凝管下端口進,上端口出
D.實驗室制取乙酸乙酯時,導氣管出口端不能插入到飽和Na2CO3溶液的液面以下
查看答案和解析>>
科目: 來源: 題型:
常用抗生素“先鋒Ⅵ”為粉末狀固體,每瓶含“先鋒Ⅵ”0.5 g,注射時應配成質量分數不高于20%的溶液,則使用時每瓶至少需加入生理鹽水(密度約為1 g/cm3)( )
A.1 mL B.2 mL C.3 mL D.4 mL
查看答案和解析>>
科目: 來源: 題型:
相對分子質量為92的某芳香烴X是一種重要的有機化工原料,研究部門以它為初始原料設計出如下轉化關系圖(部分產物、合成路線、反應條件略去)。其中A是一氯代物,H是一種功能高分子,鏈節組成為C7H5NO。
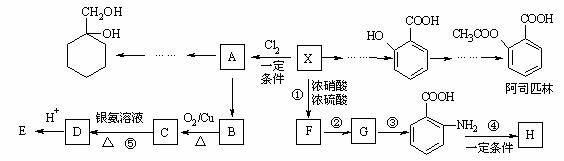
已知:
Ⅰ ![]()
Ⅱ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
請根據所學知識與本題所給信息回答下列問題:
⑴x的化學式是 ;
⑵H的結構簡式是___________________________;
⑶反應②的類型是 ;
⑷反應⑤的化學方程式是_________________________ _____;
⑸![]() 有多種同分異構體,其中含有1個醛基和2個羥基的芳香族化合物共有 種;
有多種同分異構體,其中含有1個醛基和2個羥基的芳香族化合物共有 種;
⑹請用合成反應流程圖表示出由![]() 和其他無機物合成
和其他無機物合成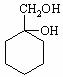 最合理的方案(不超過4步)。
最合理的方案(不超過4步)。
例:
![]()
![]()

查看答案和解析>>
科目: 來源: 題型:
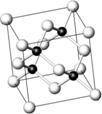 砷化鎵(GaAs)屬于第三代半導體,用它制造的燈泡壽命是普通燈泡的100倍,而耗能只有其10%。推廣砷化鎵等發光二極管(LED)照明,是節能減排的有效舉措。砷化鎵的晶胞結構如右圖。
砷化鎵(GaAs)屬于第三代半導體,用它制造的燈泡壽命是普通燈泡的100倍,而耗能只有其10%。推廣砷化鎵等發光二極管(LED)照明,是節能減排的有效舉措。砷化鎵的晶胞結構如右圖。
試回答:
(1)As的核外電子排布式為 。
(2)砷化鎵晶胞中所包含的Ga原子個數為 。
(3)下列說法正確的是 (填字母)。
A.砷化鎵晶胞結構與NaCl相同 B.第一電離能:As>Ga
C.電負性:As>Ga D.砷化鎵晶體中含有配位鍵
E.半導體GaP與GaAs互為等電子體
(4)砷化鎵是將(CH3)3Ga和AsH3用MOCVD方法在700℃時制備得到。
AsH3的空間形狀為 ,(CH3)3Ga中鎵原子的雜化方式為 。
(5)AsH3沸點比NH3低,其主要原因是 。
查看答案和解析>>
科目: 來源: 題型:
重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下,涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
試回答下列問題:
⑴在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式: 。
⑵NaFeO2能強烈水解,在操作②生成沉淀而除去,寫出該反應的化學方程式: 。
⑶操作③的目的是什么,用簡要的文字說明: 。
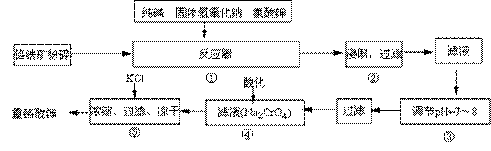 |
⑷操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式: 。
⑸稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品的中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) 。
查看答案和解析>>
科目: 來源: 題型:
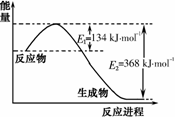 氮是地球上含量豐富的一種元素,氮元素的單質及其化合物在工農業生產、生活中有著重要作用。
氮是地球上含量豐富的一種元素,氮元素的單質及其化合物在工農業生產、生活中有著重要作用。
⑴右圖是1mol NO2和1mol CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式
⑵在固定體積的密閉容器中,進行如下化學反應:
N2(g)+3H2(g)![]() 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常數K與溫度T的關系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常數K | 4.1×106 | K1 | K2 |
①該反應的平衡常數表達式:K=
②試判斷K1 K2(填寫 “>”“=”或“<”)
③下列各項能說明該反應已達到平衡狀態的是 (填字母)
a.容器內N2、H2、NH3的濃度之比為1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器內壓強保持不變 d.混合氣體的密度保持不變
⑶對反應N2O4(g)![]() 2NO2(g) △H > 0 ,在溫度分別為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如右圖所示,下列說法正確的是 。
2NO2(g) △H > 0 ,在溫度分別為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如右圖所示,下列說法正確的是 。
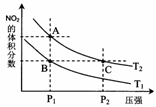 a.A、C兩點的反應速率:A>C
a.A、C兩點的反應速率:A>C
b.A、C兩點的化學平衡常數:A>C
c.A、C兩點NO2的轉化率:A<C
d.由狀態B到狀態A,可以用加熱的方法
![]() ⑷一定溫度下,在1L密閉容器中充入1molN2和3molH2并發生反應。若容器容積恒定,10min達到平衡時,氣體的總物質的量為原來的 ,則N2的轉化率a(N2)= , 以NH3表示該過程的反應速率v(NH3)= 。
⑷一定溫度下,在1L密閉容器中充入1molN2和3molH2并發生反應。若容器容積恒定,10min達到平衡時,氣體的總物質的量為原來的 ,則N2的轉化率a(N2)= , 以NH3表示該過程的反應速率v(NH3)= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com