
科目: 來源: 題型:
阿明洛芬屬于苯丙酸類抗炎藥,鎮痛效果優于布洛芬。下圖是阿明洛芬的一條合成路線。

⑴反應①為取代反應,該步反應物Me2SO4中的“Me”表示 。
⑵E中的官能團有: (寫名稱)。
⑶寫出反應類型:④ 。
⑷寫出F的結構簡式 。
⑸反應③可以看成是兩步反應的總反應,第一步是氰基(—CN)的完全水解反應生成羧基(—COOH), 請寫出第二步反應的化學方程式 。
⑹化合物![]() 是合成某些藥物的中間體。試設計合理方案由化合物
是合成某些藥物的中間體。試設計合理方案由化合物![]() 合成
合成![]() 。
。
【提示】①合成過程中無機試劑任選;
②![]() 在400攝氏度金屬氧化物條件下能發生脫羰基反應;
在400攝氏度金屬氧化物條件下能發生脫羰基反應;
③CH2=CH-CH=CH2與溴水的加成以1,4-加成為主;
④合成反應流程圖表示方法示例如下:![]()
查看答案和解析>>
科目: 來源: 題型:
2010年上海世博會場館,大量的照明材料或屏幕都使用了
發光二極管(LED)。目前市售LED品片,材質基本以GaAs
 (砷化鎵)、AlGaInP(磷化鋁鎵銦)、lnGaN(氮化銦鎵)
(砷化鎵)、AlGaInP(磷化鋁鎵銦)、lnGaN(氮化銦鎵)
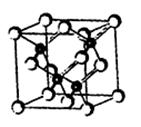
為主。已知鎵是鋁同族下一周期的元素。砷化鎵的晶胞結構
如右圖。試回答:
⑴鎵的基態原子的電子排布式是 。
⑵砷化鎵晶胞中所包含的砷原子(白色球)個數為 ,與同一個鎵原子相連的砷原子構成的空間構型為 。
⑶N、P、As處于同一主族,其氫化物沸點由高到低的順序是 。 (用氫化物分子式表示)
⑷砷化鎵可由(CH3)3Ga和AsH3在700℃時制得。(CH3)3Ga中鎵原子的雜化方式為 。
⑸比較二者的第一電離能:As______Ga(填“<”、“>”或“=”)。
⑹下列說法正確的是 (填字母)。
A.砷化鎵晶胞結構與NaCl相同 B.GaP與GaAs互為等電子體
C.電負性:As>Ga D.砷化鎵晶體中含有配位鍵
查看答案和解析>>
科目: 來源: 題型:
現代煉鋅的方法可分為火法和濕法兩大類,鎘是生產硫酸鋅的副產品,屬于高毒性金屬,試回答下列相關問題.
⑴火法煉鋅是將閃鋅礦(主要含ZnS)通過浮選、焙燒使它轉化為氧化鋅,再把氧化鋅和焦炭混合,在鼓風爐中加熱至1373-1573K,使鋅蒸餾出來。主要反應為:
2ZnS +3O2![]() 2ZnO+2SO2; 鼓風爐中:2C +O2
2ZnO+2SO2; 鼓風爐中:2C +O2![]() 2CO ZnO+CO
2CO ZnO+CO![]() Zn + CO2
Zn + CO2
從火法煉鋅蒸餾后的殘渣中含多種金屬單質及In2O3,可用硫酸提取銦,某研究機構對此研究數據如下。實驗中涉及的酸度(每升溶液中含硫酸的質量)與銦的浸出率如下圖1;硫酸溶液的體積與固體的體積比如圖2
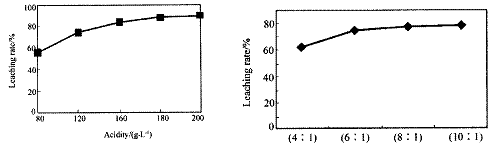
圖1酸度對銦浸出率的影響 圖2液固比對銦浸出率的影響
①當酸度為196時,其物質的量濃度為 。
②從節約原料和浸出率考慮,適宜的酸度和液固比分別為:_______、_______。
⑵濕法煉鋅的主要工藝流程為:

①從保護環境和充分利用原料角度,如何處理或利用煙氣 。
②除去酸浸出液中的鐵,可用H2O2氧化,再調節pH使之形成Fe(OH)3沉淀,寫出H2O2氧化Fe2+的離子方程式 。
③酸浸出液還含有Cd2+,為了防止鎘污染并回收鎘,根據它們性質的差異,可用氫氧化鈉溶液分離,已知Zn(OH)2和氫氧化鋁一樣也具有兩性,試寫出分離的離子方程式____________________、_______________。
查看答案和解析>>
科目: 來源: 題型:
甲醇是一種很好的燃料,工業上用CH4和H2O為原料,通過反應Ⅰ和Ⅱ來制備甲醇。

⑴將1.0 mol CH4和2.0 mol H2O(g)通入反應室(容積為100L),在一定條件下發生反應:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4的轉化率與溫度、壓強的關系如上圖。
CO(g)+3H2(g)……Ⅰ。CH4的轉化率與溫度、壓強的關系如上圖。
①已知100℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率為 。
②圖中的P1 P2(填“<”、“>”或“=”),100℃時平衡常數為 。
③該反應的△H 0(填“<”、“>”或“=”)。
⑵在壓強為0.1 MPa條件下,將a mol CO與 3a mol H2的混合氣體在催化劑作用下能自發反應生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容積不變,下列措施可增加甲醇產率的是 。
A.升高溫度 B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強增大 D.再充入1mol CO和3mol H2
 ⑤為了尋找合成甲醇的溫度和壓強的適宜條件,某同學設計了三組實驗,部分實驗條件已經填在下面實驗設計表中。
⑤為了尋找合成甲醇的溫度和壓強的適宜條件,某同學設計了三組實驗,部分實驗條件已經填在下面實驗設計表中。

A.則上表中剩余的實驗條件數據:a=________、b=_______。
B.根據反應Ⅱ的特點,右上圖是在壓強分別為0.1MPa和5MPa下CO的轉化率隨溫度變化的曲線圖,請指明圖中的壓強Px=_________MPa。
查看答案和解析>>
科目: 來源: 題型:
某校化學研究性學習小組查閱資料了解到以下內容:
乙二酸(HOOC-COOH,可簡寫為H2C2O4)俗稱草酸,易溶于水,屬于二元中強酸(為弱電解質),且酸性強于碳酸,其熔點為101.5℃,在157℃升華。為探究草酸的部分化學性質,進行了如下實驗:
⑴向盛有1 mL飽和NaHCO3溶液的試管中加入足量乙二酸溶液,觀察到有無色氣泡產生。該反應的離子方程式為________________________________。
⑵向盛有乙二酸飽和溶液的試管中滴入幾滴硫酸酸化的KMnO4溶液,振蕩,發現其溶液的紫紅色褪去,說明乙二酸具有_____________(填“氧化性”、“還原性”或“酸性”),請配平該反應的離子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
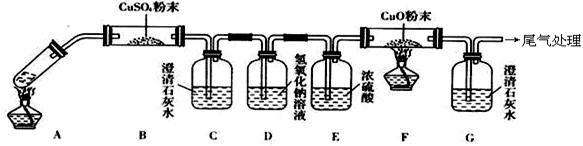 ⑶將一定量的乙二酸放于試管中,按下圖所示裝置進行實驗(夾持裝置未標出):
⑶將一定量的乙二酸放于試管中,按下圖所示裝置進行實驗(夾持裝置未標出):
實驗發現:裝置C、G中澄清石灰水變渾濁,B中CuSO4粉末變藍,F中CuO粉末變紅。據此回答:
上述裝置中,D的作用是__________________。乙二酸分解的化學方程式為______________________。
⑷該小組同學將2.52 g草酸晶體(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反應,測得反應后溶液呈酸性,其原因是___________________________________(用文字簡單表述)。
⑸以上溶液中各離子的濃度由大到小的順序為:_____________________________(用離子符號表示);
查看答案和解析>>
科目: 來源: 題型:
A、B、C、D是短周期元素形成的四種氣體單質。E、F均為氣體,且F為紅棕色。有關的轉化關系如下圖所示(反應條件均已略去)。
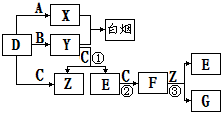
請回答下列問題:
⑴D的化學式為 。
⑵反應③的離子方程式為 。
⑶Y和E在一定條件下可反應生成B和Z,這是一個具有實際意義的反應,可消除E對環境的污染,該反應的化學方程式為 。
⑷0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等體積混合,溶液呈________性(填“酸”、“堿”或“中”),原因是_______________________________________(用離子方程式說明)。
⑸常溫下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列敘述正確的是( )
A.該溶液的pH=11
B.該溶液中的溶質電離出的陽離子濃度0.1 mol·L-1
C.該溶液中水電離出的c(H+)與c(OH-)乘積為1×10-22
D.pH=3的鹽酸溶液V1 L與該0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,則:V1>V2
E.將以上溶液加水稀釋100倍后,pH為9
查看答案和解析>>
科目: 來源: 題型:
下列各表述與示意圖一致的是 ( )
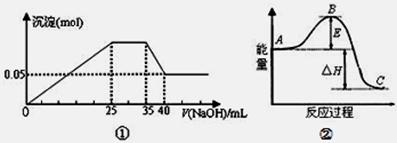
A.圖①表示向含Mg2+、Al3+、NH4+的鹽溶液中滴加NaOH溶液時,沉淀的量與NaOH的體積的關系圖。則三種離子的物質的量之比為:n(Mg2+):n(Al3+):n( NH4+)=2:3:2
B.圖①中使用的NaOH的濃度為2 mol·L-1
C.圖②中曲線表示某反應過程的能量變化。若使用催化劑,B點會降低
D.圖②中物質A反應生成物質C,△H>0
查看答案和解析>>
科目: 來源: 題型:
E是非金屬性最強的元素,M是E的氣態氫化物,在固定體積的密閉容器中,氣體M存在如下關系:
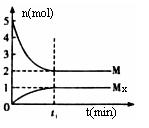 xM(g)
xM(g)![]() Mx (g),反應物和生成物的物質的量隨時間的變化關系如下圖。下
Mx (g),反應物和生成物的物質的量隨時間的變化關系如下圖。下
列說法正確的是 ( )
A.該反應的化學方程式是2HF![]() (HF)2
(HF)2
B.平衡時混合氣體的平均摩爾質量是33.3
C.t1時刻,保持溫度不變,再充入1molM,重新達到平衡時,![]() 將增大
將增大
D.M的沸點比同主族下一周期元素的氣態氫化物沸點低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com