
科目: 來源: 題型:
【題目】某種胃藥的止酸劑為碳酸鈣,測定每片中碳酸鈣含量的方法有以下幾步操作(設藥片中的其它成分不與鹽酸反應,也不與氫氧化鈉反應),實驗步驟如下:
①配制![]() 稀鹽酸和
稀鹽酸和![]() 溶液各
溶液各![]()
②取一粒藥片(![]() )研碎后加入
)研碎后加入![]() 蒸餾水
蒸餾水
③加入![]() 稀鹽酸
稀鹽酸
④用![]() 溶液中和過量鹽酸,用去體積為
溶液中和過量鹽酸,用去體積為![]() 。
。
請回答下列問題:
(1)測定過程中發生反應的離子方程式_________。
(2)配制上述![]() 稀鹽酸所用玻璃儀器有量筒、燒杯、________。
稀鹽酸所用玻璃儀器有量筒、燒杯、________。
(3)如果選用酚酞作指示劑,滴定達到終點的現象為____。
(4)某同學四次測定的![]() 數據如下:
數據如下:
測定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
請根據這位同學的實驗數據,計算藥片中碳酸鈣的質量分數為_____。
(5)若在實驗過程中存在下列操作,會使所測碳酸鈣的質量分數偏高的是_________。
a 用沒有潤洗的堿式滴定管裝![]() 溶液進行滴定
溶液進行滴定
b 用沒有潤洗的酸式滴定管量取![]() 稀鹽酸溶解樣品
稀鹽酸溶解樣品
c 用![]() 溶液滴定時,開始讀數平視,終點俯視
溶液滴定時,開始讀數平視,終點俯視
d 裝![]() 溶液的滴定管,滴定前尖嘴有氣泡,滴定結束后無氣泡。
溶液的滴定管,滴定前尖嘴有氣泡,滴定結束后無氣泡。
查看答案和解析>>
科目: 來源: 題型:
【題目】回答下列問題:
(1)![]() 溶液顯酸性,試用離子方程式解釋其原因________。
溶液顯酸性,試用離子方程式解釋其原因________。
(2)氯化銀在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C時,氯化銀的![]() ,現將足量氯化銀分別放入:①
,現將足量氯化銀分別放入:①![]() 氯化鎂溶液中,②
氯化鎂溶液中,②![]() 硝酸銀溶液中,③
硝酸銀溶液中,③![]() 氯化鋁溶液中,④
氯化鋁溶液中,④![]() 鹽酸溶液中。充分攪拌后,相同溫度下銀離子濃度由大到小的順序是___________(填寫序號)。
鹽酸溶液中。充分攪拌后,相同溫度下銀離子濃度由大到小的順序是___________(填寫序號)。
(3)下表所示的是常溫下,某些弱酸的電離常數,請根據要求作答。
弱酸 | 電離常數 | 弱酸 | 電離常數 |
|
|
|
|
|
|
|
|
①相同物質的量濃度的![]() 和
和![]() 的混合溶液中離子濃度由大到小的順序為_________。
的混合溶液中離子濃度由大到小的順序為_________。
②請判斷![]() 溶液顯_________性(填“酸”、“堿”或“中”)。
溶液顯_________性(填“酸”、“堿”或“中”)。
③下列離子方程式書寫正確的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
科目: 來源: 題型:
【題目】Ⅰ.回答下列問題:
(1)烴A的結構簡式為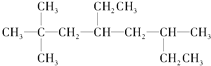 ,用系統命名法命名烴A:____________。
,用系統命名法命名烴A:____________。
(2)某烴的分子式為![]() ,核磁共振氫譜圖中顯示4個峰,則該烴的一氯代物有_______種,該烴的結構簡式為____________。
,核磁共振氫譜圖中顯示4個峰,則該烴的一氯代物有_______種,該烴的結構簡式為____________。
(3)麻黃素又稱黃堿,是我國特定中藥材麻黃中所含有的一種生物堿。經科學家研究發現其結構為: ,下列各物質:A.
,下列各物質:A. 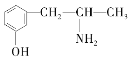 B.
B. ![]() C.
C. 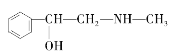 D.
D. 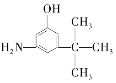 E.
E. 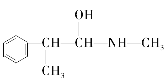
與麻黃素互為同分異構體的是_________(填字母,下同),互為同系物的是___________(填字母)。
Ⅱ.有機物C常用于食品行業。已知![]() 在足量
在足量![]() 中充分燃燒,將生成的混合氣體依次通過足量的濃硫酸和堿石灰,分別增重
中充分燃燒,將生成的混合氣體依次通過足量的濃硫酸和堿石灰,分別增重![]() 和
和![]() ,經檢驗剩余氣體為
,經檢驗剩余氣體為![]() 。
。
(1)C分子的質譜圖如圖所示,從圖中可知其相對分子質量是________,則C的分子式是_______。
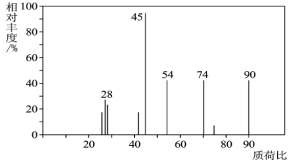
(2)C能與![]() 溶液發生反應,C一定含有的官能團是_____________。
溶液發生反應,C一定含有的官能團是_____________。
(3)C分子的核磁共振氫譜有4個峰,峰面積之比是![]() ,則C的結構簡式是________。
,則C的結構簡式是________。
(4)![]() 與
與![]() 的氫氧化鈉溶液反應,需溶液的體積是_____
的氫氧化鈉溶液反應,需溶液的體積是_____![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】短周期元素a、b、c、d的原子序數依次增大。其中A為d元素組成的非金屬單質;甲、乙、丙、丁、戊為上述四種元素組成的二元或三元化合物,常溫下乙為液體。下列說法正確的是( )

A.簡單離子半徑:c>b
B.反應①為吸熱反應
C.②反應中氧化劑與還原劑物質的量之比為1:1
D.b、d分別與a形成的化合物中,化學鍵類型一定完全相同
查看答案和解析>>
科目: 來源: 題型:
【題目】Ⅰ.回答下列問題:
(1)量子力學把電子在原子核外的一個空間運動狀態稱為一個________,還有一種狀態叫做________。
(2)寫出![]() 原子的外圍電子排布式:______,其在周期表中的位置________,其在周期表中處于______區,與
原子的外圍電子排布式:______,其在周期表中的位置________,其在周期表中處于______區,與![]() 同周期的所有副族元素的基態原子中,最外層電子數與
同周期的所有副族元素的基態原子中,最外層電子數與![]() 相同的元素有_________種。
相同的元素有_________種。
(3)下列![]() 原子電子排布圖表示的狀態中,能量最低和最高的分別為_______、_______(填標號)。
原子電子排布圖表示的狀態中,能量最低和最高的分別為_______、_______(填標號)。
A 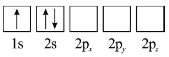 B
B 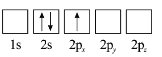
C 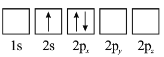 D
D 
Ⅱ.有A、B、C、D、E五種元素,其中A、B、C屬于同一周期,A原子最外層![]() 能級的電子數等于次外層的電子總數, B元素可分別與A、C、D生成
能級的電子數等于次外層的電子總數, B元素可分別與A、C、D生成![]() 型化合物,并知在
型化合物,并知在![]() 中,
中,![]() 與
與![]() 的質量比為
的質量比為![]() 原子的價電子排布式為
原子的價電子排布式為![]() 。根據以上條件,回答下列問題:
。根據以上條件,回答下列問題:
(1)C的基態原子的電子占據最高能層的符號為_______,![]() 原子的價電子排布圖________。
原子的價電子排布圖________。
(2)A、B、C三種元素的第一電離能由大到小的順序______(用元素符號表示)。
(3)元素B和D的電負性由大到小的順序_________(用元素符號表示)。
(4)寫出E的元素符號_________,要證明太陽光中含有E元素,可采用的方法是__________。
查看答案和解析>>
科目: 來源: 題型:
【題目】Ⅰ.合成氨工業中,每生產![]() ,放出
,放出![]() 熱量。
熱量。
(1)寫出合成氨反應的熱化學方程式___________。
(2)已知:

![]() 鍵斷裂吸收的能量等于_______
鍵斷裂吸收的能量等于_______![]() (計算結果取整數)。
(計算結果取整數)。
Ⅱ.人工腎臟可用間接電化學方法除去代謝產物中的尿素[化學式為![]() ],原理如圖。
],原理如圖。
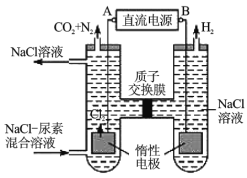
(1)電源的負極為__________(填“A”或“B”)。
(2)陽極室中發生的反應依次為_________,_________。
(3)電解結束后,陰極室溶液的![]() 與電解前相比將__________(填“增大”、“減小”或“不變”)。
與電解前相比將__________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】碳酸亞乙酯是一種重要的添加劑,其結構簡式為![]() 。用環氧乙烷合成碳酸亞乙酯的反應為:
。用環氧乙烷合成碳酸亞乙酯的反應為:![]() +CO2
+CO2![]() 。下列說法錯誤的是( )
。下列說法錯誤的是( )
A.上述反應屬于加成反應
B.碳酸亞乙酯的所有二氯代物中均存在手性碳原子
C.碳酸亞乙酯中的所有氧原子處于同一平面內
D.1mol碳酸亞乙酯最多可消耗2molNaOH
查看答案和解析>>
科目: 來源: 題型:
【題目】研究表明,大氣中氮氧化物和碳氫化合物受紫外線作用可產生二次污染物——光化學煙霧,其中某些反應過程如圖所示。下列說法不正確的是

A. 整個過程中O3作催化劑
B. 反應III的方程式為O2+O===O3
C. 光化學煙霧中含甲醛、乙醛等刺激性物質
D. 反應I、反應Ⅱ均屬于氧化還原反應
查看答案和解析>>
科目: 來源: 題型:
【題目】鈹銅是廣泛應用于制造高級彈性元件的良好合金。某科研小組從某舊鈹銅元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收鈹和銅兩種金屬的工藝流程如圖:
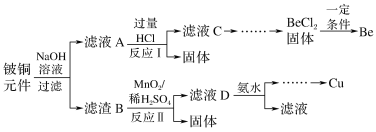
已知:Ⅰ.鈹、鋁元素的化學性質相似,單質鈹與氫氧化鈉溶液反應生成可溶于水的Na2BeO2
Ⅱ.常溫下部分難溶物的溶度積常數如下表:
難溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度積常數(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)濾液A的主要成分除NaOH外,還有__(填化學式),寫出反應I中含鈹化合物與過量鹽酸反應的離子方程式:__。
(2)①濾液C中含NaCl、BeCl2和少量HCl,為提純BeCl2,最合理的實驗步驟順序為__(填字母)。
a.加入過量的氨水 b.通入過量的CO2 c.加入過量的NaOH d.加入適量的HCl e.洗滌 f.過濾
②從BeCl2溶液中得到BeCl2固體的操作是__。
(3)①MnO2能將金屬硫化物中的硫元素氧化為硫單質。寫出反應Ⅱ中CuS發生反應的化學方程式:__。
②若用濃HNO3溶解金屬硫化物,缺點是__(任寫一條)。
(4)濾液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水調節pH可將其依次分離,首先沉淀的是__(填離子符號),為使銅離子開始沉淀,常溫下應調節溶液的pH大于__。
(5)電解NaCl-BeCl2混合熔鹽可制備金屬鈹,如圖是電解裝置圖。
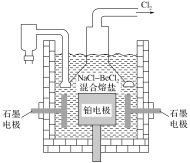
①石墨電極上的電極反應式為__。
②電解得到的Be蒸氣中約含1%的Na蒸氣除去Be中少量Na的方法為__。
已知部分物質的熔、沸點如下表:
物質 | 熔點(K) | 沸點(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
查看答案和解析>>
科目: 來源: 題型:
【題目】在常溫下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的
溶液,混合溶液的![]() 變化情況如圖中所示曲線(體積變化忽略不計)。下列敘述正確的是( )
變化情況如圖中所示曲線(體積變化忽略不計)。下列敘述正確的是( )
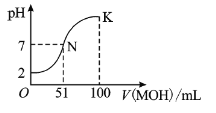
A.![]() 溶液的
溶液的![]() B.
B.![]() 點時加水稀釋溶液,
點時加水稀釋溶液,![]() 減小
減小
C.在![]() 點,
點,![]() D.在
D.在![]() 點,
點,![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com