
科目: 來源: 題型:
【題目】下列說法中正確的是
A. NO2、BF3、NCl3分子中沒有一個分子中原子的最外層電子都滿足了8電子穩定結構
B. P4和CH4都是正四面體形分子且鍵角都為109°28′
C. NH4+的電子式為 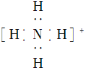 ,離子呈平面正方形結構
,離子呈平面正方形結構
D. NH3分子中有一對未成鍵的孤電子對,它對成鍵電子的排斥作用較強
查看答案和解析>>
科目: 來源: 題型:
【題目】錳及其化合物在工農業生產和科技領域具有廣泛的應用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化為MnO4-,同時(NH4)2S2O8被還原為SO42-,該方法可用于檢驗Mn2+。
(1)用酸性(NH4)2S2O8溶液檢驗Mn2+時的實驗現象為____。
(2)該反應的離子方程式為____。
(3)已知H2S2O8中硫的化合價為+6,若硫酸的結構簡式為![]() ,則H2S2O8的結構簡式為____。
,則H2S2O8的結構簡式為____。
Ⅱ.實驗室用含錳廢料(主要成分為MnO2,還含有少量Al2O3、MgO、SiO2)為原料制備Mn的工藝流程如圖所示。
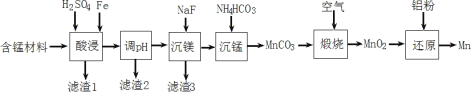
已知:①部分難溶物的溶度積常數如下表所示。
難溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度積常數 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②當溶液中離子濃度≤1.0×10-5molL-1時,可認為該離子沉淀完全。
(1)“酸浸”時,MnO2將Fe氧化為Fe3+,該反應的離子方程式為____;該過程中浸出時間和液固比對錳浸出率的影響分別如圖所示。
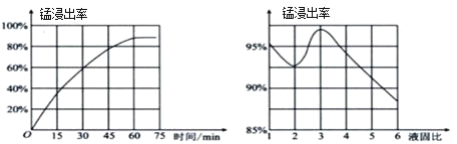
則適宜的浸出時間和液固比分別為____、____。
(2)若“酸浸”后所得濾液中c(Mn2+)=0.18molL-1,則應“調pH”的范圍為____。
(3)“煅燒”反應中氧化劑與還原劑的物質的量之比為____。“還原”時發生的置換反應在化學上又叫作____。
查看答案和解析>>
科目: 來源: 題型:
【題目】下表是元素周期表的一部分,請針對表中所列標號為①~⑩的元素回答下列問題。
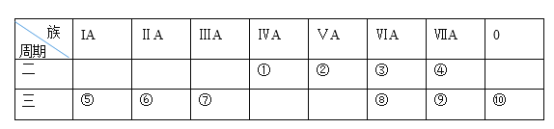
(1)非金屬性最強的元素是______(填元素符號,下同),形成化合物種類最多的元素是________________________。
(2)第三周期元素除⑩外原子半徑最小的是______(填元素符號),
(3)這些元素的最高價氧化物對應水化物中堿性最強的是__________(填化學式,下同),具有兩性的是____________。
(4)⑤、⑧兩種元素的最高價氧化物對應的水化物相互反應的離子方程式為____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】現有含有少量NaCl、Na2SO4、Na2CO3等雜質的NaNO3溶液,選擇適當的試劑除去雜質,得到純凈的NaNO3固體,實驗流程如下圖所示。
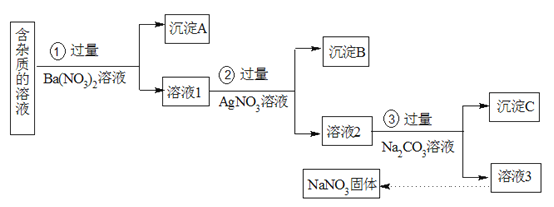
(1)沉淀A的主要成分是_________(填化學式)。
(2)②中反應的離子方程式是_________。
(3)③加入過量的Na2CO3溶液的目的是________。
(4)溶液3中肯定含有的雜質是_______,為除去雜質可向溶液3中加入過量的_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】乙醇和乙酸是生活中兩種常見的有機物。請回答下列問題:
(1)乙醇的結構簡式為CH3CH2OH,乙醇的官能團名稱為__________;乙酸的結構簡式為CH3COOH,乙酸的官能團名稱為__________;生活中常用食醋除去暖瓶內的水垢(主要成分是CaCO3),反應的化學方程式為2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通過這個事實,你得出醋酸與碳酸的酸性強弱關系是:醋酸_____碳酸(填“>”或“<”);
(2)在濃硫酸的催化作用下,加熱乙酸和乙醇的混合溶液,可發生酯化反應。請完成化學方程式:CH3COOH + CH3CH2OH CH3COOCH2CH3+________。
查看答案和解析>>
科目: 來源: 題型:
【題目】黃色超氧化鉀(![]() )可作為宇宙飛船艙的氧源。某學習小組設計以下實驗探究
)可作為宇宙飛船艙的氧源。某學習小組設計以下實驗探究![]() 的性質,請回答相關問題:
的性質,請回答相關問題:
Ⅰ.探究![]() 與水的反應:取少量
與水的反應:取少量![]() 固體于試管中,滴加少量水快速產生氣泡,將帶火星的木條靠近試管口木條復燃;滴加酚酞試液,溶液先變紅后褪色。向褪色后溶液中滴加
固體于試管中,滴加少量水快速產生氣泡,將帶火星的木條靠近試管口木條復燃;滴加酚酞試液,溶液先變紅后褪色。向褪色后溶液中滴加![]() 溶液,產生的現象為____________________________________。
溶液,產生的現象為____________________________________。
Ⅱ.探究![]() 與
與![]() 的反應:
的反應:
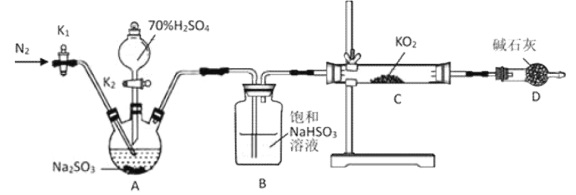
(1)檢查上述裝置氣密性的方法是__________________________________。
(2)正確的操作依次是_________________________。(操作可重復選擇)
①打開![]() 通入
通入![]() ,并維持一段時間后關閉 ②實驗完成,拆卸裝置 ③檢查裝置氣密性,然后裝入藥品 ④打開分液漏斗活塞
,并維持一段時間后關閉 ②實驗完成,拆卸裝置 ③檢查裝置氣密性,然后裝入藥品 ④打開分液漏斗活塞![]()
(3)A裝置發生反應的化學方程式為________________________。
(4)用上述裝置驗證“![]() 與
與![]() 反應生成
反應生成![]() ”還存在不足,你的改進措施是___________________。
”還存在不足,你的改進措施是___________________。
(5)改進后再實驗,待![]() 完全反應后,將裝置C中固體加水溶解,配成
完全反應后,將裝置C中固體加水溶解,配成![]() 溶液,等分為
溶液,等分為![]() 兩份。
兩份。
①向M溶液中加入足量的鹽酸酸化的![]() 溶液,充分反應后,將沉淀過濾、_______、________,稱重為4.66g。
溶液,充分反應后,將沉淀過濾、_______、________,稱重為4.66g。
②將N溶液移入錐形瓶中,用![]() 酸性
酸性![]() 溶液滴定,當出現_______________現象時,達到滴定終點,此時消耗酸性
溶液滴定,當出現_______________現象時,達到滴定終點,此時消耗酸性![]() 溶液
溶液![]() 。
。
③依據上述現象和數據,請寫出裝置C中總反應的化學方程式___________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某化學研究性學習小組利用以下裝置制取并探究氨氣的性質。在A裝置中發生反應的化學方程式為2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

(1)B裝置中的干燥劑是_____(填“堿石灰”或“濃硫酸”)。
(2)C、D裝置中試紙顏色會發生變化的是_____(填”C”或“D”)。
(3)當實驗進行段時間后,擠壓E裝置中的膠頭滴管,滴入1--2滴濃鹽酸,可觀察到E裝置中的現象是產生______(填”煙”或“白霧”)。
(4)為防止過量氨氣造成空氣污染,需要在上述裝置的末端增加一個尾氣處理裝置,合適的裝置是_____(填“F”或“G”)。
(5)生石灰與水反應生成Ca(OH)2并放出熱量。實驗室利用此原理,向生石灰中滴加濃氨水,可以快速制取氨氣。用此方法制取氨氣應選用的氣體發生裝置是____(填“a”“b”或“c”)。

查看答案和解析>>
科目: 來源: 題型:
【題目】工業上制硫酸的一步重要反應是2SO2(g)+O2(g)![]() 2SO3(g),此反應在某條件下的某密閉反應容器中達到化學平衡狀態。下列有關說法不正確的是( )
2SO3(g),此反應在某條件下的某密閉反應容器中達到化學平衡狀態。下列有關說法不正確的是( )
A.此時,SO2的轉化率達到最大程度
B.此時,SO2的消耗速率等于SO2的生成速率
C.此時,SO3的濃度保持不變
D.該反應達到化學平衡狀態后反應停止
查看答案和解析>>
科目: 來源: 題型:
【題目】W、X、Y、Z是四種常見的短周期主族元素,其原子半徑隨原子序數的變化如右圖所示。已知Y、Z兩種元素的單質是空氣的主要成分,W原子的最外層電子數與Ne原子的最外層電子數相差1。請回答下列問題:
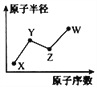
(1)寫出四種元素的元素符號:X____ Y____ Z____ W____
(2)HYO3的酸性比HWO強,有人據此認為Y的非金屬性強于W,你認為這種看法是否正確___,說明理由__________________________________。
(3)甲和乙分別是由W、X、Y、Z四種元素中的三種元素組成的常見化合物,化合物甲具有漂白消毒殺菌作用,其化學式為________;化合物乙是一種常見的強酸,會因保存不當而變成黃色液體,其原因是_______________________________。把紅熱的木炭投入黃色液體,劇烈反應,方程式為_____________________,將產生的氣體通過澄清石灰水時氣體變為無色,但未見有渾濁現象,原因是______________。(寫出有關反應的化學方程式)
查看答案和解析>>
科目: 來源: 題型:
【題目】控制含碳、氮、硫的化合物等大氣污染物對打造宜居環境具有重要意義。
(1)已知反應![]() 的
的![]() 分子中化學鍵斷裂時分別需要吸收
分子中化學鍵斷裂時分別需要吸收![]() 的能量,則
的能量,則![]() 分子中化學鍵斷裂時需要吸收的能量為______kJ。
分子中化學鍵斷裂時需要吸收的能量為______kJ。
(2)用![]() 消除
消除![]() 污染的反應原理如下:
污染的反應原理如下:![]() ,不同溫度條件下,
,不同溫度條件下,![]() 與NO的物質的量之比分別為
與NO的物質的量之比分別為![]() 時,得到
時,得到![]() 脫除率曲線如圖所示:
脫除率曲線如圖所示:
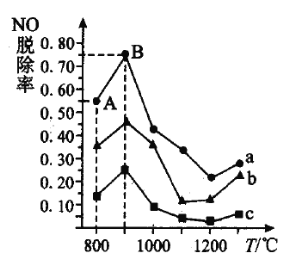
曲線![]() 對應
對應![]() 與
與![]() 的物質的量之比是_______。
的物質的量之比是_______。
②曲線![]() 中
中![]() 的起始濃度為
的起始濃度為![]() ,從
,從![]() 點到
點到![]() 點經過
點經過![]() ,該時間段內
,該時間段內![]() 的脫除速率為_________________
的脫除速率為_________________![]() 。
。
(3)已知常溫下電離平衡常數:![]() 的
的![]() 的
的![]() 。
。
①溶液中下列微粒可以大量共存的是___________(填字母)。
a.![]() b.
b.![]() c.
c.![]()
②常溫下,某種碳酸鈉與碳酸氫鈉混合溶液的![]() ,則
,則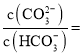 _____________。
_____________。
(4)利用電解法處理高溫空氣中稀薄的![]() (
(![]() 濃度約為
濃度約為![]() 的10倍),裝置示意圖如圖所示,固體電解質可傳導
的10倍),裝置示意圖如圖所示,固體電解質可傳導![]() 。
。
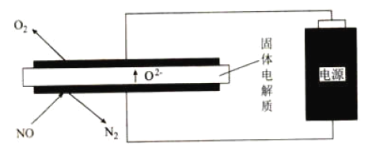
①陰極的電極反應式為_______________。
②消除一定量的![]() 所消耗的電量遠遠大于理論計算量,可能的原因是(不考慮物理因素)__________。
所消耗的電量遠遠大于理論計算量,可能的原因是(不考慮物理因素)__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com