
科目: 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是( )
A.向AgCl、AgBr的飽和溶液中加入少量AgNO3,溶液中![]() 不變
不變
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D.向0.1molL-1CH3COOH 溶液中加入少量水,溶液中 減小
減小
查看答案和解析>>
科目: 來源: 題型:
【題目】鉑鈷合金是以鉑為基含鈷二元合金,在高溫下,鉑與鈷可無限互溶,其固體為面心立方晶格。鉑鈷合金磁性極強,磁穩定性較高,耐化學腐蝕性很好,主要用于航天航空儀表、電子鐘表、磁控管等。氟及其化合物用途非常廣泛。回答下列問題:
(1)聚四氟乙烯是一種準晶體,準晶體是一種無平移周期序,但有嚴格準周期位置序的獨特晶體,可通過____方法區分晶體準晶體和非晶體。
(2)基態F原子的價層電子排布圖(軌道表達式)為______。
(3)[H2F]+[SbF6]-(氟銻酸)是一種超強酸,存在[H2F]+,該離子的空間構型為______,與[H2F]+具有相同空間構型和鍵合形式的分子和陰離子分別是______(各舉一例)。
(4)NH4F(氟化銨)可用于玻璃的蝕刻防腐劑、消毒劑。NH4+中中心原子的雜化類型是______;氟化銨中存在______(填字母)。
A.離子鍵B.σ鍵C.π鍵D.氫鍵
(5)SF6被廣泛用作高壓電氣設備的絕緣介質。SF6是一種共價化合物,可通過類似于Born-Haber循環能量構建能量圖計算相關鍵能。則F-F鍵的鍵能為______kJmol-1,S-F鍵的鍵能為______kJmol-1。
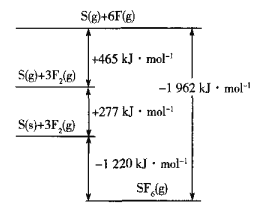
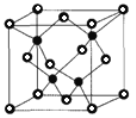
(6)CuCl的熔點為426℃,熔化時幾乎不導電;CuF的熔點為908℃,密度為7.1gcm-3。
①CuF的熔點比CuCl的高,原因是______
②已知NA為阿伏加德羅常數的值,CuF的晶胞結構如圖(b)所示,則CuF的晶胞參數a=______nm(列出計算式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】t°C時,在一未知體積的密閉容器中充入2molA和3molB,發生如下化學反應: aA(g)+B(g) ![]() C(g)+D(g),已知其化學平衡常數為1,在溫度不變的情況下,擴大容器容積至原來10倍,結果A的百分含量始終未有改變,則此時B的轉化率是( )
C(g)+D(g),已知其化學平衡常數為1,在溫度不變的情況下,擴大容器容積至原來10倍,結果A的百分含量始終未有改變,則此時B的轉化率是( )
A.40%B.60%C.50%D.無法確定
查看答案和解析>>
科目: 來源: 題型:
【題目】反應N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化的曲線如圖所示。下列說法正確的是
2NO2(g) ΔH=+57kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化的曲線如圖所示。下列說法正確的是
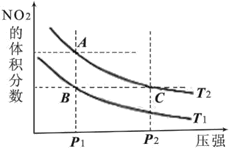
A.A、C兩點的反應速率:A>C
B.A、C兩點氣體的顏色:A深,C淺
C.A、B兩點氣體的平均相對分子質量:A>B
D.B、C兩點化學平衡常數:B<C
查看答案和解析>>
科目: 來源: 題型:
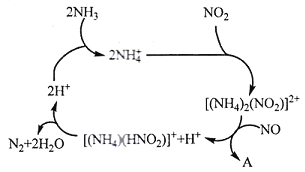
【題目】含氮化合物對環境、生產和人類生命活動等具有很大的影響。請按要求回答下列問題
(1)利用某分子篩作催化劑,NH3可脫除工廠廢氣中的NO、NO2,反應機理如下圖所示。A包含物質為H2O和___________(填化學式)
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
則反應4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工業上利用氨氣生產氫氰酸(HCN的反應為:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他條件一定,達到平衡時NH3轉化率隨外界條件X變化的關系如圖甲所示。則X可以是___________(填字母序號)
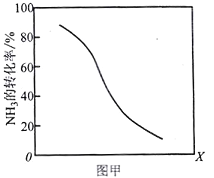
a.溫度 b.壓強 c.催化劑 d.![]()
②在一定溫度下,向2L密閉容器中加入 n mol CH4和2 moI NH3,平衡時NH3體積分數隨n變化的關系如圖乙所示。
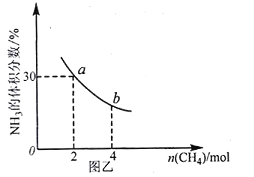
a點時,CH4的轉化率為___________%;平衡常數:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌紅蛋白(Mb)與O2結合生成MbO2,其反應原理可表示為: Mb(ag)+O2(g)![]() MbO2(aq),該反應的平衡常數可表示為:
MbO2(aq),該反應的平衡常數可表示為:![]() 。在37℃條件下達到平衡時,測得肌紅蛋白的結合度(a)與P(O2)的關系如圖丙所示[
。在37℃條件下達到平衡時,測得肌紅蛋白的結合度(a)與P(O2)的關系如圖丙所示[![]() ]。研究表明正反應速率ν正=k正·c(Mb) · P(O2),逆反應速率ν逆=k逆·c(MbO2)(其中k正和k逆分別表示正反應和逆反應的速率常數)。
]。研究表明正反應速率ν正=k正·c(Mb) · P(O2),逆反應速率ν逆=k逆·c(MbO2)(其中k正和k逆分別表示正反應和逆反應的速率常數)。
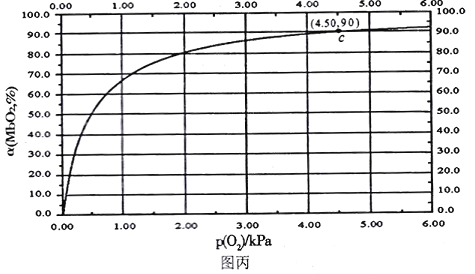
①試寫出平衡常數K與速率常數k正、k逆之間的關系式為K=___________(用含有k正、k逆的式子表示)。
②試求出圖丙中c點時,上述反應的平衡常數K=___________kPa-1。已知k逆=60s-1,則速率常數k正=___________s-1·kPa-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】在25℃時,甘氨酸在水溶液中解離情況如下:H3N+CH2COOH(A+)![]() H3N+CH2COO-(A±)
H3N+CH2COO-(A±)![]() H2NCH2COO-(A-),改變溶液pH值,三種甘氨酸相關離子的分布分數(α,平衡時某物種的濃度占各物種濃度之和的分數)變化如圖所示。當調節溶液的pH值使甘氨酸所帶的凈電荷為零,此時溶液的pH叫等電點。下列說法正確的是( )
H2NCH2COO-(A-),改變溶液pH值,三種甘氨酸相關離子的分布分數(α,平衡時某物種的濃度占各物種濃度之和的分數)變化如圖所示。當調節溶液的pH值使甘氨酸所帶的凈電荷為零,此時溶液的pH叫等電點。下列說法正確的是( )
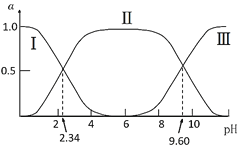
A.曲線Ⅰ、Ⅱ、Ⅲ分別代表的微粒為A、A±、A+
B.K2=102.34,且K2對應的解離基團為-NH3+
C.在pH=9.60的溶液中加鹽酸,α(A±)+α(A+)+α(A)保持不變
D.甘氨酸的等電點pH約為6,且存在c(A±)=c(A+)=c(A)
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于熱化學反應的描述中正確的是
A. HCl和NaOH反應的中和熱ΔH=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g) =2CO(g)+O2(g)反應的ΔH=+2×283.0kJ/mol
C. 需要加熱才能發生的反應一定是吸熱反應
D. 1mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱
查看答案和解析>>
科目: 來源: 題型:
【題目】根據下述轉化關系,回答問題:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物質苯環上一鹵代物只有兩種。
(1)寫出B物質的名稱__________;D物質的結構簡式________。
(2)寫出反應②的類型________;反應⑤的條件________。
(3)寫出反應⑥的化學方程式:________________________________。
(4)寫出D+E反應的化學方程式:_______________。
(5)反應②還有可能生成一種C16H18的有機物,其苯環上一鹵代物也只有兩種,寫出它的結構簡式:_______________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】2019年諾貝爾化學獎頒布給了三位為鋰電池發展作出重要貢獻的科學家,磷酸鐵鋰離子電池充電時陽極反應式為LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放電工作原理示意圖如圖。下列說法不正確的是
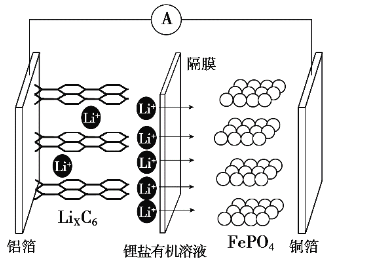
A.放電時,Li+通過隔膜移向正極
B.放電時,電子由鋁箔沿導線流向銅箔
C.放電時正極反應為FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸鐵鋰離子電池充電過程通過Li+遷移實現,C、Fe、P元素化合價均不發生變化
查看答案和解析>>
科目: 來源: 題型:
【題目】結構的研究是有機化學最重要的研究領域.某有機物X(C12H13O6Br)分子中含有多種官能團,其結構簡式如下:(其中Ⅰ、Ⅱ為未知部分的結構).

為推測X的分子結構,進行如圖轉化:

已知向D的水溶液中滴入FeCl3溶液顯紫色,對D的結構進行光譜分析,在氫核磁共振譜上顯示只有兩種信號.M、N互為同分異構體,M中含有一個六原子環,N能使溴的四氯化碳溶液褪色,G能與NaHCO3溶液反應.請回答:
(1)G分子所含官能團的名稱是__;
(2)D不可以發生的反應有(選填序號)__;
①加成反應 ②消去反應 ③氧化反應 ④取代反應
(3)寫出上圖轉化中反應①和②的化學方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能發生顯色反應,則X的結構簡式是:___________,1mol該 X與足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一種化工產品的中間體W與G互為同分異構體,W的分子中只含有羧基、羥基和醛基三種官能團,且同一個碳原子上不能同時連有兩個羥基.則W的分子結構有__種,寫出任意一種的結構簡式___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com