
科目: 來源: 題型:
【題目】天然氣是一種重要的清潔能源和化工原料,其主要成分為甲烷。
![]() 已知:
已知:![]() ,則反應
,則反應![]() ______ 。
______ 。
![]() 天然氣的一個重要用途是制取
天然氣的一個重要用途是制取![]() ,其原理為:
,其原理為:![]() 。一定條件下,在密閉容器中,通入物質的量濃度均為
。一定條件下,在密閉容器中,通入物質的量濃度均為![]() 的
的![]() 與
與![]() ,在發生反應時,測得
,在發生反應時,測得![]() 的平衡轉化率與溫度及壓強的關系如圖1所示,
的平衡轉化率與溫度及壓強的關系如圖1所示,
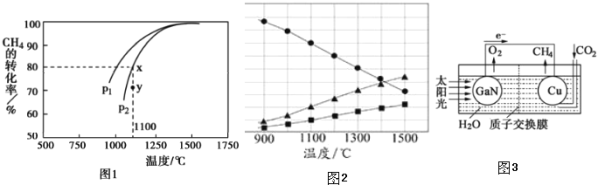
![]() 該反應的平衡常數表達式為______ 。
該反應的平衡常數表達式為______ 。
![]() 壓強
壓強![]() ______
______ ![]() 填“大于”或“小于”
填“大于”或“小于”![]() ;壓強為
;壓強為![]() 時,在Y點:
時,在Y點:![]() 正
正![]() ______
______ ![]() 逆
逆![]() 填“大于“、“小于”或“等于“
填“大于“、“小于”或“等于“![]() 。
。
![]() 天然氣中的少量
天然氣中的少量![]() 雜質常用氨水吸收,產物為
雜質常用氨水吸收,產物為![]() 。一定條件下向
。一定條件下向![]() 溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式為______ 。
溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式為______ 。
![]() 工業上又常將從天然氣分離出的
工業上又常將從天然氣分離出的![]() ,在高溫下分解生成硫蒸氣和
,在高溫下分解生成硫蒸氣和![]() ,若反應在不同溫度下達到平衡時,混合氣體中各組分的體積分數如圖2所示,
,若反應在不同溫度下達到平衡時,混合氣體中各組分的體積分數如圖2所示,![]() 在高溫下分解反應的化學方程式為______ 。
在高溫下分解反應的化學方程式為______ 。
![]() 科學家用氮化鎵材料與銅組裝如圖3的人工光合系統,利用該裝置成功地實現了以
科學家用氮化鎵材料與銅組裝如圖3的人工光合系統,利用該裝置成功地實現了以![]() 和
和![]() 合成
合成![]() 。
。
![]() 寫出銅電極表面的電極反應式為______ 。
寫出銅電極表面的電極反應式為______ 。
![]() 為提高該人工光合系統的工作效率,可向裝置中加入少量______
為提高該人工光合系統的工作效率,可向裝置中加入少量______ ![]() 選填“鹽酸”或“硫酸”
選填“鹽酸”或“硫酸”![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】ZnSe是一種光電性能優異的半導體材料,某研究小組用如圖1方法制備了ZnSe.

![]() 溶于水生成
溶于水生成![]() ,下列物質與水反應,跟此反應類型相同的是 ______
,下列物質與水反應,跟此反應類型相同的是 ______
![]()
![]()
![]()
![]()
![]()
![]() 硒酸
硒酸![]() 的水溶液按下式發生一級和二級電離:
的水溶液按下式發生一級和二級電離:![]() ;
;![]() ,
,![]()
![]() 溶液顯 ______
溶液顯 ______ ![]() 填“酸性”、“中性”、“堿性”
填“酸性”、“中性”、“堿性”![]() .
.
![]() 向
向![]() 溶液中滴加少量氨水,該反應的離子方程式為 ______ .
溶液中滴加少量氨水,該反應的離子方程式為 ______ .
![]() 已知
已知![]() 的兩級電離常數分別為
的兩級電離常數分別為![]() ,
,![]() ,則
,則![]() 和
和![]() 兩溶液混合后反應的離子方程式為 ______ .
兩溶液混合后反應的離子方程式為 ______ .
![]() 肼
肼![]() 與
與![]() 反應的氧化產物是
反應的氧化產物是![]() 氧化劑與還原劑的物質的量之比為 ______ .
氧化劑與還原劑的物質的量之比為 ______ .
![]() 電化學降解法可用于治理水中硝酸鹽的污染,所得產物可直接排入大氣.其原理如圖2所示,其中B為電源的 ______ 極,乙池中電極反應式為 ______ ,為使反應持續進行,須適時向甲池中添加 ______ .
電化學降解法可用于治理水中硝酸鹽的污染,所得產物可直接排入大氣.其原理如圖2所示,其中B為電源的 ______ 極,乙池中電極反應式為 ______ ,為使反應持續進行,須適時向甲池中添加 ______ .
查看答案和解析>>
科目: 來源: 題型:
【題目】從海水中提取鎂的流程如圖所示(框圖中是主要產物):
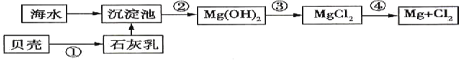
請回答相關問題。
(1)下列說法不正確的是____________。
A.上述方法的優點之一是原料取自大海 B.進行①②③步驟的目的是富集![]()
C.工業上也可用電解熔融氧化鎂的方法制取鎂 D.電解法冶煉金屬要消耗大量的電能
(2)步驟③中發生反應的離子方程是__________________________。
(3)步驟④中發生反應的化學方程式是___________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】電化學原理在防止金屬腐蝕、能量轉換、物質合成等方面應用廣泛。

(1)圖1中,為了減緩海水對鋼閘門A的腐蝕,材料B可以選擇__________(填字母)。
a.碳棒b.鋅板c.銅板

(2)鎂燃料電池在可移動電子設備電源和備用電源等方面應用前景廣闊。圖2為“鎂—次氯酸鹽”燃料電池原理示意圖,電極為鎂合金和鉑合金。
①E為該燃料電池的________(填“正”或“負”)極。F電極上的電極反應式為____________________________________________________________。
②鎂燃料電池負極容易發生自腐蝕產生氫氣,使負極利用率降低,用化學用語解釋其原因_________________________________________________________________________。

(3)乙醛酸(HOOC-CHO)是有機合成的重要中間體。工業上用“雙極室成對電解法”生產乙醛酸,原理如圖3所示,該裝置中陰、陽兩極為惰性電極,兩極室均可產生乙醛酸,其中乙二醛與M電極的產物反應生成乙醛酸。
①N電極上的電極反應式為_______________________________________________________。
②若有2mol H+通過質子交換膜,并完全參與了反應,則該裝置中生成的乙醛酸為________mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】標準狀況下,![]() 某無色可燃性氣體在足量氧氣中完全燃燒。將產物通入足量澄清石灰水中,得到白色沉淀的質量為
某無色可燃性氣體在足量氧氣中完全燃燒。將產物通入足量澄清石灰水中,得到白色沉淀的質量為![]() ;若用足量堿石灰吸收燃燒產物,則堿石灰增重
;若用足量堿石灰吸收燃燒產物,則堿石灰增重![]() 。
。
(1)計算燃燒產物中水的質量_____________。
(2)若原氣體是單一氣體,通過計算推斷它的分子式___________________。
(3)若原氣體是兩種等物質的量的氣體的混合物,其中只有一種是烴,請寫出它們的分子式________________(只要求寫出一組)。
查看答案和解析>>
科目: 來源: 題型:
【題目】為探究乙烯與溴的加成反應,甲同學設計并進行如下實驗:先取一定量的工業用乙烯氣體(在儲氣瓶中),使氣體通入溴水中,發現溶液褪色,即證明乙烯與溴水發生了加成反應;乙同學發現在甲同學的實驗中,褪色后的溶液里有少許淡黃色渾濁物質,推測在工業上制得的乙烯中還可能含有少量還原性氣體雜質,由此他提出必須先除去雜質,再讓乙烯與溴水反應。請回答下列問題:
(1)甲同學設計的實驗________(填“能”或“不能”)驗證乙烯與溴發生了加成反應,其理由是________(填序號)。
①使溴水褪色的反應不一定是加成反應
②使溴水褪色的反應就是加成反應
③使溴水褪色的物質不一定是乙烯
④使溴水褪色的物質就是乙烯
(2)乙同學推測此乙烯中一定含有的一種雜質氣體是________,它與溴水反應的化學方程式是________________。在實驗前必須全部除去,除去該雜質的試劑可用________。
(3)為驗證乙烯與溴發生的反應是加成反應而不是取代反應,丙同學提出可用![]() 試紙來測試反應后溶液的酸性,理由是_____________________________________________________________________________。
試紙來測試反應后溶液的酸性,理由是_____________________________________________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】對于反應CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他條件不變的情況下
CO 2(g)+ H 2(g) △H﹤0,在其他條件不變的情況下
A. 加入催化劑,改變了反應的途徑,反應的△H也隨之改變
B. 改變壓強,平衡不發生移動,反應放出的熱量不變
C. 升高溫度,反應速率加快,反應放出的熱量不變
D. 若在原電池中進行,反應放出的熱量不變
查看答案和解析>>
科目: 來源: 題型:
【題目】含鉻化合物有毒,對人畜危害很大.因此含鉻廢水必須進行處理才能排放.
已知:![]()
![]() 在含
在含![]() 價鉻的廢水中加入一定量的硫酸和硫酸亞鐵,使
價鉻的廢水中加入一定量的硫酸和硫酸亞鐵,使![]() 價鉻還原成
價鉻還原成![]() 價鉻;再調節溶液pH在
價鉻;再調節溶液pH在![]() 之間,使
之間,使![]() 和
和![]() 轉化為
轉化為![]() 、
、![]() 沉淀而除去.
沉淀而除去.
![]() 寫出
寫出![]() 與
與![]() 溶液在酸性條件下反應的離子方程式 ______ .
溶液在酸性條件下反應的離子方程式 ______ .
![]() 用離子方程式表示溶液pH不能超過10的原因 ______ .
用離子方程式表示溶液pH不能超過10的原因 ______ .
![]() 將含
將含![]() 價鉻的廢水放入電解槽內,用鐵作陽極,加入適量的氯化鈉進行電解.陽極區生成的
價鉻的廢水放入電解槽內,用鐵作陽極,加入適量的氯化鈉進行電解.陽極區生成的![]() 和
和![]() 發生反應,生成的
發生反應,生成的![]() 和
和![]() 在陰極區與
在陰極區與![]() 結合成氫氧化物沉淀而除去.
結合成氫氧化物沉淀而除去.
![]() 寫出陰極的電極反應式 ______ .
寫出陰極的電極反應式 ______ .
![]() 電解法中加入氯化鈉的作用是 ______ .
電解法中加入氯化鈉的作用是 ______ .
![]() 某化學興趣小組以含
某化學興趣小組以含![]() 價鉻和
價鉻和![]() 價錳的工業廢水為試樣,研究鐵屑用量和pH值對廢水中鉻、錳去除率的影響.
價錳的工業廢水為試樣,研究鐵屑用量和pH值對廢水中鉻、錳去除率的影響.
![]() 取100mL廢水于250mL三角瓶中,調節pH值到規定值,分別加入不同量的廢鐵屑.得到鐵屑用量對鉻和錳去除率的影響如圖1所示.則在pH一定時,廢水中鐵屑用量為 ______ 時,錳、鉻去除率最好.
取100mL廢水于250mL三角瓶中,調節pH值到規定值,分別加入不同量的廢鐵屑.得到鐵屑用量對鉻和錳去除率的影響如圖1所示.則在pH一定時,廢水中鐵屑用量為 ______ 時,錳、鉻去除率最好.
![]() 取100mL廢水于250mL三角瓶中,加入規定量的鐵粉,調成不同的pH值.得到pH值對鉻和錳去除率的影響如圖2所示.則在鐵屑用量一定時,廢水
取100mL廢水于250mL三角瓶中,加入規定量的鐵粉,調成不同的pH值.得到pH值對鉻和錳去除率的影響如圖2所示.則在鐵屑用量一定時,廢水![]() ______ 時,錳、鉻去除率最好.
______ 時,錳、鉻去除率最好.

查看答案和解析>>
科目: 來源: 題型:
【題目】反應A+B→C △H <0,分兩步進行 ① A+B→X △H>0 ② X→C △H<0 。下列示意圖中,能正確表示總反應過程中能量變化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 來源: 題型:
【題目】金屬鎵有“電子工業脊梁”的美譽,它與鋁同主族,曾被稱為“類鋁”,其氧化物和氫氧化物均為兩性化合物。工業制備鎵的流程如下圖所示:

(1)元素Ga位于Al的下一周期,寫出鎵(Ga)的原子結構示意圖為____________CO2的電子式為_____________________
(2)下列有關Al、Ga的說法不正確的是______
A.由流程圖可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可與鹽酸反應生成GaCl3
C.Ga(OH)3可由Ga2O3與水反應得到 D.與酸反應的劇烈程度:Al<Ga
(3)圖中涉及到的Al、Na、O三種元素簡單離子半徑由大到小的順序_____________
(4)步驟二中不能通入過量的CO2,理由_________________(用離子方程式表示)
(5)工業上通常用電解精煉法提純鎵。某待提純的粗鎵內含Zn、Fe、Cu雜質,以NaOH水溶液為電解質溶液。在電流作用下使粗鎵溶解進入電解質溶液,通過某種離子遷移技術到達陰極,并在陰極放電析出高純鎵。(離子氧化性順序為:Zn2+<Ga3+<Fe2+)
①下列有關電解精煉說法正確的是_______
A.陽極發生氧化反應,其主要電極反應式:Ga-3e- ═ Ga3+
B.電解過程中,陽極質量的減少與陰極質量的增加相等
C.在陰極除了析出高純度的鎵之外,還有H2產生
D.電解后,電解槽底部的陽極泥中只有Cu和Fe
②陰極析出高純度鎵的電極反應式__________________________________
(6)氮化鎵在電和光的轉化方面性能突出,是迄今理論上光電轉化效率最高的材料。氮化鎵(GaN)的一種制備方法是采用GaCl3與NH3在一定條件下反應,寫出該反應的化學方程式__________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com