
【題目】金屬鎵有“電子工業脊梁”的美譽,它與鋁同主族,曾被稱為“類鋁”,其氧化物和氫氧化物均為兩性化合物。工業制備鎵的流程如下圖所示:

(1)元素Ga位于Al的下一周期,寫出鎵(Ga)的原子結構示意圖為____________CO2的電子式為_____________________
(2)下列有關Al、Ga的說法不正確的是______
A.由流程圖可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可與鹽酸反應生成GaCl3
C.Ga(OH)3可由Ga2O3與水反應得到 D.與酸反應的劇烈程度:Al<Ga
(3)圖中涉及到的Al、Na、O三種元素簡單離子半徑由大到小的順序_____________
(4)步驟二中不能通入過量的CO2,理由_________________(用離子方程式表示)
(5)工業上通常用電解精煉法提純鎵。某待提純的粗鎵內含Zn、Fe、Cu雜質,以NaOH水溶液為電解質溶液。在電流作用下使粗鎵溶解進入電解質溶液,通過某種離子遷移技術到達陰極,并在陰極放電析出高純鎵。(離子氧化性順序為:Zn2+<Ga3+<Fe2+)
①下列有關電解精煉說法正確的是_______
A.陽極發生氧化反應,其主要電極反應式:Ga-3e- ═ Ga3+
B.電解過程中,陽極質量的減少與陰極質量的增加相等
C.在陰極除了析出高純度的鎵之外,還有H2產生
D.電解后,電解槽底部的陽極泥中只有Cu和Fe
②陰極析出高純度鎵的電極反應式__________________________________
(6)氮化鎵在電和光的轉化方面性能突出,是迄今理論上光電轉化效率最高的材料。氮化鎵(GaN)的一種制備方法是采用GaCl3與NH3在一定條件下反應,寫出該反應的化學方程式__________________
【答案】
![]() A C O2->Na+>Al3+ GaO2-+CO2+2H2O ==Ga(OH)3↓+HCO3- (或 2GaO2-+CO2+3H2O ==2Ga(OH)3↓+CO32- ) CD GaO2-+3e-+2H2O=Ga+4OH- GaCl3+NH3
A C O2->Na+>Al3+ GaO2-+CO2+2H2O ==Ga(OH)3↓+HCO3- (或 2GaO2-+CO2+3H2O ==2Ga(OH)3↓+CO32- ) CD GaO2-+3e-+2H2O=Ga+4OH- GaCl3+NH3 ![]() GaN+3HCl
GaN+3HCl
【解析】
(1)依據Ga在元素周期表的位置分析;CO2分子構型為直線形,碳元素與氧元素之間為碳氧雙鍵;
(2)根據元素周期律、強酸制弱酸作答;
(3)電子層數越多,離子半徑越大;電子層數相同時,核電荷數越小,其離子半徑越大;
(4)生成氫氧化鋁沉淀后過量的二氧化碳還可以與偏鎵酸鈉反應;
(5)①依據電解精煉金屬的原理解答;
②依據電解池的工作原理,陰極得電子生成Ga單質;
(6)根據給定條件,結合元素守恒書寫化學方程式。
(1)元素Ga位于Al的下一周期,則位于第四周期IIIA族,其核外電子數為13+18 = 31,所以Ga原子結構示意圖為: , CO2的電子式為
, CO2的電子式為![]() ,故答案為:
,故答案為: ;
;![]() ;
;
(2)A. 在NaAlO2和NaGaO2溶液中通入CO2之后生成Al(OH)3,并未生成Ga(OH)3,根據強酸制弱酸的原理可知,酸性:Ga(OH)3>Al(OH)3,A項錯誤;
B. 因Al2O3可與鹽酸反應生成AlCl3,兩者同族,性質相似,所以Ga2O3可與鹽酸反應生成GaCl3,B項正確;
C. Al(OH)3不可以由Al2O3與水反應得到,根據元素的相似性可知,Ga(OH)3也不可由Ga2O3與水反應得到,C項錯誤;
D. 同主族元素,其金屬性依次增強,所以與酸反應的劇烈程度依次增大,即Al<Ga,D項正確,
故答案為:AC;
(3)電子層數越多,離子半徑越大;電子層數相同時,核電荷數越小,其離子半徑越大;Al、Na、O三種元素簡單離子半徑由大到小的順序為O2->Na+>Al3+,
故答案為:O2->Na+>Al3+;
(4)若通入過量的CO2,GaO2-會和CO2、H2O反應生成Ga(OH)3沉淀,其離子方程式為:GaO2-+CO2+2H2O ==Ga(OH)3↓+HCO3- (或 2GaO2-+CO2+3H2O ==2Ga(OH)3↓+CO32- ),
故答案為:GaO2-+CO2+2H2O ==Ga(OH)3↓+HCO3- (或 2GaO2-+CO2+3H2O ==2Ga(OH)3↓+CO32- );
(5)①A. 陽極為粗鎵,金屬失電子發生氧化反應,主要電極反應式為:Zn-2e-=Zn2+、Ga-3e- ═ Ga3+,A項錯誤;
B. 電解過程中陽極失電子的有Zn、Ga;陰極析出的是Ga;依據電子守恒,陽極質量的減少與陰極質量的增加不相等,B項錯誤;
C. 在開始放電的瞬間,陰極除了析出高純度的鎵之外,溶液中的氫離子也會放電生成氫氣,C項正確;
D. 由離子氧化性順序:Zn2+<Ga3+<Fe2+可知,粗鎵中含有的少量Fe、Cu不失電子,沉降到電解池底部形成陽極泥,電解后,電解槽底部的陽極泥中只有Cu和Fe,D項正確;
故答案為CD;
②陰極GaO2-得電子生成Ga,電極反應式為:GaO2-+3e-+2H2O=Ga+4OH-,
故答案為:GaO2-+3e-+2H2O=Ga+4OH-;
(6)氮化鎵(GaN)的一種制備方法是采用GaCl3與NH3在一定條件下反應,可以看出元素化合價均未發生變化,則該反應的化學方程式為:GaCl3+NH3 ![]() GaN+3HCl,
GaN+3HCl,
故答案為:GaCl3+NH3 ![]() GaN+3HCl。
GaN+3HCl。


科目:高中化學 來源: 題型:
【題目】氮及其化合物在科學研究和化工生產等領域都有著廣泛的應用。請回答下列問題:
(1)與氮元素同族的第四周期元素的基態原子價層電子軌道表達式為___________。
(2)尿素分子的結構簡式為:CO(NH2)2,該分子中σ鍵數目為___________,實驗測得:分子中的所有原子在同一平面內,尿素中的碳氧鍵(125pm)比典型的碳氧雙鍵(121pm)長,而尿素中的碳氮鍵(137pm)比典型的碳氮單鍵(147pm)短,說明分子中存在____________。
(3)氨分子構型為_________,氨晶體中,氨分子中的每個H 均參與一個氫鍵的形成,1 mol固態氨中有_____mol氫鍵。
(4)通常認為Cu3N是離子晶體,其晶格能可通過圖(a)的Born-Haber循環計算得到。

可知, Cu原子的第一電離能為_____kJmol1,N≡N鍵鍵能為_____kJmol1,Cu3N晶格能為_____kJmol1。
(5)Cu3N晶體的晶胞如圖(b)所示。晶胞邊長為anm,晶胞中N3- 位于Cu+所形成的正八 面體的體心,該正八面體的邊長為____nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)0.25mol的氣態高能燃料乙炔(C2H2)在氧氣中完全燃燒,生成氣態CO2和氣態水,放出389kJ,則其熱化學方程式為____。
(2)又知H2O(l)→H2O(g)-44kJ,則22.4L(標準狀況)乙炔氣體完全燃燒生成液態水時放出的熱量是___kJ;若將足量的氧氣與39g乙炔氣體充分反應,實際只有2000kJ的能量被有效利用,則此時能量的利用率為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據vt圖分析外界條件改變對可逆反應A(g)+3B(g) ![]() 2C(g) ΔH<0的影響。該反應的速率與時間的關系如圖所示:
2C(g) ΔH<0的影響。該反應的速率與時間的關系如圖所示:

可見在t1、t3、t5、t7時反應都達到平衡,如果t2、t4、t6、t8時都只改變了一個反應條件,則下列對t2、t4、t6、t8時改變條件的判斷正確的是
A. 使用了催化劑、增大壓強、減小反應物濃度、降低溫度
B. 升高溫度、減小壓強、減小反應物濃度、使用了催化劑
C. 增大反應物濃度、使用了催化劑、減小壓強、升高溫度
D. 升高溫度、減小壓強、增大反應物濃度、使用了催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有含NaCl、Na2SO4、NaNO3的混合溶液,選擇適當的試劑將其轉化為相應的沉淀或固體,從而實現Cl﹣、SO42﹣、NO3﹣的相互分離。相應的實驗過程可用如圖表示:

(1)寫出上述實驗過程中所用試劑的名稱:試劑1___,試劑2___。
(2)檢測原溶液中含有SO42-的方法是___。
(3)加入過量試劑3的目的是___。
(4)圖2是NaNO3,Na2SO4和Na2SO410H2O的溶解度曲線(g/100g水),則從NaNO3 和Na2SO4的混合溶液中得到Na2SO4固體的操作是:將混合液___→__→用乙醇洗滌→干燥。用乙醇洗滌而不用水洗的原因是___。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】沙羅特美是一種長效平喘藥,其合成的部分路線如下:

(1)F中的含氧官能團名稱為____________。
(2)A的名稱為____________。
(3)D→E的反應類型為____________,沙羅特美的分子式為____________。
(4)B的分子式為C8H8O3,與(CH3)2C(OCH3)2發生取代反應得到物質C和CH3OH,寫出B的結構簡式:____________________。
(5)判斷同時滿足下列條件的C的同分異構體的數目:_______。(不考慮立體異構)
①分子中含有![]() 結構且只有一個環狀結構,與FeCl3發生顯色反應;
結構且只有一個環狀結構,與FeCl3發生顯色反應;
②能與NaHCO3發生反應放出CO2。
③苯環上有且只有三個取代基
(6)請寫出以 、(CH3)2C(OCH3)2、CH3NO2為原料制備
、(CH3)2C(OCH3)2、CH3NO2為原料制備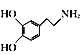 的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。_____________
的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關有機化合物(a)![]() (b)
(b)![]() (c)
(c)![]() 的說法正確的是
的說法正確的是
A. (a)(b)(c)均能與溴水發生化學反應
B. (b)二氯代物有兩種
C. (a)(b)(c)互為同分異構體
D. (a)中所有原子可能共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應:aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:
cC(g)(ΔH<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:

回答問題:
(1)反應的化學方程式中,a∶b∶c為 ;
(2)A的平均反應速率vⅠ(A)、vⅡ(A)、vⅢ(A)從大到小排列次序為 ;
(3)B的平衡轉化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移動的方向是 ,采取的措施是 ;
(5)比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低:T2 T3(填“>”“<”或“=”),判斷的理由是 ;
(6)達到第三次平衡后,將容器的體積擴大一倍,假定10 min后達到新的平衡,請在下圖中用曲線表示第Ⅳ階段體系中各物質的濃度隨時間變化的趨勢(曲線上必須標出A、B、C)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四川盛產五倍子。以五倍子為原料可制得化合物A。A的結構簡式如下圖所示。請解答下列各題:

(1)A的分子式是__________________。
(2)有機化合物B在硫酸催化條件下加熱發生酯化反應可得到A。請寫出B的結構簡式_________________。
(3)請寫出A與過量NaOH溶液反應的化學方程式_________________。
(4)有機化合物C是合成治療禽流感藥物的原料之一。C可以看成是B與氫氣按物質的量之比1∶2發生加成反應得到的產物。C分子中無羥基與碳碳雙鍵直接相連的結構,它能與溴水反應使溴水褪色。請寫出C與溴水反應的化學方程式: _________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com