
科目: 來源: 題型:
【題目】納米材料一直是人們研究的重要課題,例如納米級Fe粉表面積大,具有超強的磁性、高效催化性等優良的性質。
Ⅰ.實驗室采用氣相還原法制備納米級Fe,其流程如圖所示::
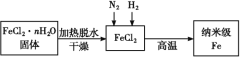
(1)納米級Fe和稀鹽酸反應的離子方程式為_____。
(2)如何將FeCl2·nH2O固體加熱脫水制得無水FeCl2:____(用簡要文字描述)。
(3)生成納米級Fe的化學方程式為____。
Ⅱ.查閱資料:在不同溫度下,納米級Fe粉與水蒸氣反應的固體產物不同,溫度低于570℃時生成FeO,高于570℃時生成Fe3O4。甲同學用圖甲所示裝置進行納米級Fe粉與水蒸氣反應的實驗,乙同學用圖乙所示的裝置進行納米級Fe粉與水蒸氣的反應并驗證產物。
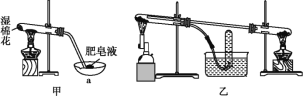
(4)甲裝置中納米級Fe粉與水蒸氣反應的化學方程式是_____。
(5)甲裝置中儀器a的名稱為_____。
(6)丁同學稱取5.60gFe粉,用乙裝置反應一段時間后,停止加熱。將試管內的固體物質在干燥器中冷卻后,稱得質量為6.88g,則丁同學實驗后的固體物質中氧化物的質量分數為_____(結果保留三位有效數字)。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列實驗操作、現象和結論均正確的是( )
選項 | 實驗操作 | 現象 | 結論 |
A | 向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液 | 無明顯現象 | 不能用硝酸和BaCl2溶液檢驗SO |
B | 向AlCl3溶液中滴加過量氨水 | 溶液澄清 | AlCl3與NH3·H2O能大量共存 |
C | 將可調高度的銅絲伸入到稀HNO3中 | 溶液變藍 | Cu與稀HNO3發生置換反應 |
D | 將KI和FeCl3溶液在試管中混合后,加入CCl4,震蕩,靜置 | 下層溶液顯紫紅色 | 氧化性:Fe3+>I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】甲、乙、丙、丁四種短周期元素的位置如圖所示(其中乙、丙、丁的位置未標出)。
![]()
已知四種元素的原子序數之和為36,乙的原子序數與甲、丁原子序數之和相等。
(1)甲元素在周期表中的位置為______________。
(2)丙、丁可形成AB2型化合物,其化學式為________。
(3)丙是自然界中形成化合物種類最多的元素,則丙是________(填名稱),其單質與甲元素的最高價氧化物對應水化物的濃溶液共熱時反應的化學方程式是______________________。
(4)若甲、乙、丙、丁四種元素兩兩化合時,丁與其他三種元素得到的化合物種類最多,則丁是________(填元素符號),寫出這些化合物中任意兩種符合以下條件的化學式______________________
(①原子個數比為1∶2;②分子中價電子總數為偶數)。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關從海帶中提取碘的實驗原理和裝置能達到實驗目的的是

A. 用裝置甲灼燒碎海帶
B. 用裝置乙過濾海帶灰的浸泡液
C. 用裝置丙制備用于氧化浸泡液中I的Cl2
D. 用裝置丁吸收氧化浸泡液中I后的Cl2尾氣
查看答案和解析>>
科目: 來源: 題型:
【題目】無水氯化鋁在生產、生活中應用廣泛。
(1)氯化鋁在水中形成具有凈水作用的氫氧化鋁膠體,其反應的離子方程式為___________。
(2)工業上用鋁土礦(主要成分為Al2O3,含有Fe2O3 、SiO2等雜質)制取無水氯化鋁的一種工藝流程示意如下:
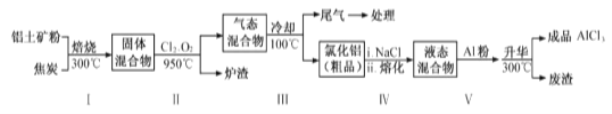
已知:

①步驟Ⅰ中焙燒使固體水分揮發、氣孔數目增多,其作用是_____(只要求寫出一種)。
②步驟Ⅱ中若不通入氯氣和氧氣,則反應生成相對原子質量比硅大的單質是_____。
③步驟Ⅲ的尾氣經冷卻至室溫后,氣體用足量的NaOH冷溶液吸收,生成的鹽主要有3種,其化學式分別為_________________________。
④結合流程及相關數據分析,步驟Ⅴ中加入鋁粉的目的是_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)聯氨(又稱肼,N2H4,無色液體)為二元弱堿,在水中的電離方式與氨相似。寫出在水中聯氨第一步電離反應的方程式_______________。氯化鎂溶液在某條件下可生Mg(OH)Cl沉淀,請寫出相關離子方程式_________
(2)實驗室可通過向盛裝有堿石灰的錐形瓶中滴加濃氨水來制取氨氣,請利用相關化學反應原理來解釋______________________________
(3)室溫下向10mL0.1 mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的變化曲線如圖所示
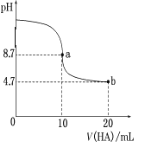
則HA為_______電解質(填“強”或“弱”),a點所示溶液c(Na)_____c(A)(填“>”、“<”或“”=),a、b兩點所示溶液中水的電離程度a_______b(填“>”、“<”或“"=)。
(4)25℃時0.05mol/L的醋酸溶液,pH=______ 該溶液中水電離出的c(H+)=____(已知室溫下醋酸電離平衡常數為2.0×10-5)
(5)常溫下,0.01mol/L的HCN溶液加水稀釋1000倍的過程中,下列選項增大的是_____
A.![]() B.Kac(HCN) C.
B.Kac(HCN) C.![]() D.
D.![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】下表中離子方程式及其評價均合理的是( )
選項 | 化學反應及離子方程式 | 評價 |
A | 氧化亞鐵溶于稀硝酸FeO+2H+=Fe2++H2O | 堿性氧化物與酸反應生成鹽和水,正確 |
B | 向亞硫酸銨溶液中加少量氫氧化鋇溶液Ba2++SO | 復分解反應,有沉淀生成,正確 |
C | 含nmolFeBr2的溶液中通入nmolCl2完全反應:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化還原反應離子方程式滿足元素守恒、電子守恒、電荷守恒,正確 |
D | 氯化鐵溶液中滴入硫氰化鉀溶液:Fe3++3SCN-=Fe(SCN)3 | 復分解反應,無氣體生成,無沉淀生成,不正確 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】鐵氧體(Fe3O4)法是處理含廢鉻水的常用方法,其原理是用FeSO4把廢水中Cr2O![]() 還原為Cr3+,并通過調節廢水的pH,使生成物組成符合類似于鐵氧體(Fe3O4或Fe2O3FeO)的復合氧化物(
還原為Cr3+,并通過調節廢水的pH,使生成物組成符合類似于鐵氧體(Fe3O4或Fe2O3FeO)的復合氧化物(![]() )。CrxFe2-xO3FeO處理含1molCr2O
)。CrxFe2-xO3FeO處理含1molCr2O![]() 廢水至少需要加入amolFeSO47H2O。下列結論正確的是( )
廢水至少需要加入amolFeSO47H2O。下列結論正確的是( )
A.x=0.5,a=10B.x=1,a=5C.x=2,a=l0D.x=0.5,a=8
查看答案和解析>>
科目: 來源: 題型:
【題目】下列8種化學符號:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符號共______種。
(2)互為同位素的是________________。
(3)質量相同的H216O和D216O所含中子數之比為________。
根據周期表對角線規則,金屬Be與Al單質及其化合物性質相似。試回答下列問題:
(4)寫出Be與NaOH溶液反應生成Na2BeO2的離子方程式:___________________________。
(5)Be(OH)2與Mg(OH)2可用____________________試劑鑒別。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于離子檢驗的說法中正確的是( )
A.向某溶液中加稀鹽酸,將產生的無色無味氣體通入澄清石灰水中,石灰水變渾濁,則原溶液中一定含有大量CO![]()
B.向某溶液中加入鹽酸酸化的硝酸鋇溶液,有白色沉淀產生,則原溶液中一定有SO![]()
C.向某溶液中加入濃氫氧化鈉溶液并加熱,產生的氣體能使濕潤的紅色石蕊試紙變藍,則原溶液呈堿性
D.向某溶液中加入硝酸銀溶液產生白色沉淀,再加稀硝酸,沉淀不消失,則原溶液中一定有Cl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com