
科目: 來源: 題型:
【題目】將0.1 mol·L-1的氨水加水稀釋至0.01 mol·L-1,稀釋過程中溫度不變,下列敘述正確的是( )
A.稀釋后溶液中c(H+)和c(OH-)均減小
B.稀釋后溶液中c(OH-)變為稀釋前的1/10
C.稀釋過程中氨水的電離平衡向左移動
D.稀釋過程中溶液中 增大
增大
查看答案和解析>>
科目: 來源: 題型:
【題目】(某混合物甲中含有明礬[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定條件下由甲可實現如圖所示的物質之間的轉化:

請回答下列問題:
(1)寫出A、B的化學式:A___,B___。
(2)試劑a最好選用下列試劑中的(______)
A.NaOH溶液 B.稀鹽酸 C.二氧化碳 D.氨水
寫出相應的離子方程式___。
(3)寫出反應②(生成溶液C和沉淀)的離子方程式___。
(4)固體D可以作為復合性的化學肥料,D中所含物質的化學式為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】根據要求完成下列每一小題
(1)根據系統命名法,![]() 的名稱是___;
的名稱是___;
(2)根據系統命名法![]() 的名稱是___;
的名稱是___;
(3)根據系統命名法 的名稱是___;
的名稱是___;
(4) 核磁共振氫譜吸收峰面積之比是___。
核磁共振氫譜吸收峰面積之比是___。
查看答案和解析>>
科目: 來源: 題型:
【題目】銅鐵及其化合物在日常生活中應用廣泛,某研究性學習小組用粗銅![]() 含雜質
含雜質![]() 與過量氯氣反應得固體A,用稀鹽酸溶解A,然后加試劑調節溶液的pH后得溶液B,溶液B經系列操作可得氯化銅晶體,請回答:
與過量氯氣反應得固體A,用稀鹽酸溶解A,然后加試劑調節溶液的pH后得溶液B,溶液B經系列操作可得氯化銅晶體,請回答:
![]() 溶液B經過________、__________、___________可得到氯化銅晶體;
溶液B經過________、__________、___________可得到氯化銅晶體;
![]() 檢驗溶液B中是否存在
檢驗溶液B中是否存在![]() 的方法是_________;
的方法是_________;
![]() 下列物質適合于調節溶液的pH得溶液B的是________
下列物質適合于調節溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高價態時常表現氧化性,若在酸性
已知元素在高價態時常表現氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加熱,生成CuCl沉淀,則生成CuCl的離子方程式是____________
和NaCl溶液,加熱,生成CuCl沉淀,則生成CuCl的離子方程式是____________
查看答案和解析>>
科目: 來源: 題型:
【題目】電化學原理在防止金屬腐蝕、能量轉換等方面應用廣泛。
(1)①鋼鐵在海水中容易發生電化學腐蝕,正極反應式是__________。
②圖中,為減緩鋼閘門的腐蝕,材料B可以選擇__________(填“Zn”或“Cu”)。
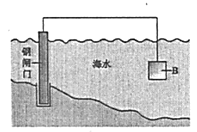
(2)如圖為鋼鐵防護模擬實驗裝置,則鐵做__________極,檢測鋼鐵保護效果的方法是:取少量鐵電極附近的溶液于試管中,_________,則說明保護效果好。

(3)氫氧燃料電池是一種新型的化學電源,其構造如圖所示:

a、b為多孔石墨電極,通入的氣體由孔隙中逸出,并在電極表面放電。
①a的電極反應式是_________;
②若電池共產生3.6g水,則電路中通過了_______mol的電子。
查看答案和解析>>
科目: 來源: 題型:
【題目】研究人員最近發現了一種“水”電池,這種電池能利用淡水與海水之間含鹽量的差別進行發電,在海水中電池總反應可表示為:![]() ,“水”電池在放電時:
,“水”電池在放電時:
(1)該電池的負極的電極反應式為__________________________
(2)![]() 不斷向“水”電池的_________極移動
不斷向“水”電池的_________極移動
(3)每有![]() 電子轉移,生成_________
電子轉移,生成_________![]()
(4)將該“水”電池與如圖所示的裝置相連

![]() 、Y為石墨,a為2L一定物質的量濃度的KCl溶液,電解一段時間發現Y極附近產生了黃綠色氣體,寫出電解總反應的化學方程式_____________.
、Y為石墨,a為2L一定物質的量濃度的KCl溶液,電解一段時間發現Y極附近產生了黃綠色氣體,寫出電解總反應的化學方程式_____________.
![]() 、Y分別為鐵、銅,a為
、Y分別為鐵、銅,a為![]() 和
和![]() 的混合溶液,電池與X、Y的連接方式與
的混合溶液,電池與X、Y的連接方式與![]() 相同,Y極的電極反應式為 ____________.
相同,Y極的電極反應式為 ____________.
(5)室溫時,取上述![]() 中
中![]() 電解一段時間后的溶液,除去其中的
電解一段時間后的溶液,除去其中的![]() 且不引入新的雜質
且不引入新的雜質![]() 得到溶液甲,將甲溶液逐滴加入到20ml等物質的量濃度的醋酸中,得到如圖
得到溶液甲,將甲溶液逐滴加入到20ml等物質的量濃度的醋酸中,得到如圖![]() 不考慮能量損失和氣體溶于水,溶液體積變化忽略不計
不考慮能量損失和氣體溶于水,溶液體積變化忽略不計![]()

![]() 醋酸的電離平衡常數:C點________B點
醋酸的電離平衡常數:C點________B點![]() 填“
填“![]() ”,“
”,“![]() ”或“
”或“![]() ”
” ![]()
![]() 點溶液中的溶質是:_____________
點溶液中的溶質是:_____________![]() 填化學式
填化學式![]()
![]() 圖中,從A點到D點的下列有關說法正確的是______________
圖中,從A點到D點的下列有關說法正確的是______________![]() 填字母
填字母![]()
![]() 點時測得溶液中水電離的
點時測得溶液中水電離的![]() 濃度為
濃度為![]() ,則原醋酸溶液的濃度為
,則原醋酸溶液的濃度為![]()
![]() 點時,
點時,![]()
![]() 點時,已知
點時,已知![]() 的
的![]() 大于
大于![]() 的
的![]() ,則溶液中離子濃度的大小關系為:
,則溶液中離子濃度的大小關系為:![]()
![]() 點的溶液
點的溶液![]() 冷卻至室溫
冷卻至室溫![]() 等于7
等于7
查看答案和解析>>
科目: 來源: 題型:
【題目】為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3DZn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3DZn—NiOOH二次電池,結構如下圖所示。電池反應為Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充電時陽極反應為___。
⑵放電時負極反應為___。
⑶放電過程中OH-通過隔膜從區移向___。
查看答案和解析>>
科目: 來源: 題型:
【題目】新型氨法煙氣脫硫技術的化學原理是采用氨水吸收煙氣中的![]() ,再用一定量的磷酸與上述吸收產物反應。該技術的優點除了能回收利用
,再用一定量的磷酸與上述吸收產物反應。該技術的優點除了能回收利用![]() 外,還能得到一種復合肥料。
外,還能得到一種復合肥料。
(1)①若氨水與![]() 恰好完全反應生成正鹽,則此時溶液呈________性
恰好完全反應生成正鹽,則此時溶液呈________性![]() 填“酸”或“堿”
填“酸”或“堿”![]() 。常溫下弱電解質的電離平衡常數如下:氨水
。常溫下弱電解質的電離平衡常數如下:氨水![]()
![]() 溶液中通入________氣體可使溶液呈中性。
溶液中通入________氣體可使溶液呈中性。![]() 填“
填“![]() ”或
”或![]() ”
”![]() 此時溶液中
此時溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
(2)向![]() 溶液通入過量
溶液通入過量![]() ,充分反應后所得溶液中離子濃度大小順序為________________。
,充分反應后所得溶液中離子濃度大小順序為________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】CO和NO都是汽車尾氣中的有害物質,它們之間能緩慢地發生如下反應:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,現利用此反應,擬設計一種環保裝置,用來消除汽車尾氣對大氣的污染,下列設計方案可以提高尾氣處理效率的是( )
①選用適當的催化劑 ②提高裝置溫度 ③降低裝置的壓強 ④裝置中放入堿石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖所示,某同學設計了一個燃料電池并探究氯堿工業原理的相關問題,其中乙裝置中X為陽離子交換膜。請按要求回答相關問題:

(1)石墨電極(C)作___極,丙池中滴有酚酞,實驗開始后觀察到的現象是_____,甲中甲烷燃料電池的負極反應式為________。
(2)若消耗2.24 L(標況)氧氣,則乙裝置中鐵電極上生成的氣體體積(標況)為___ L。
(3)丙中以CuSO4溶液為電解質溶液進行粗銅(含Al、Zn、Ag、Pt、Au等雜質)的電解精煉,下列說法正確的是_______。
A.b電極為粗銅
B.粗銅接電源正極,發生還原反應
C.CuSO4溶液的濃度保持不變
D.利用陽極泥可回收Ag、Pt、Au等金屬
(4)若丙中以稀H2SO4為電解質溶液,電極材料b為鋁,則能使鋁表面生成一層致密的氧化膜,該電極反應式為__________。
(5)假設乙裝置中氯化鈉溶液足夠多,若在標準狀況下,有224 mL氧氣參加反應,則乙裝置中陽離子交換膜,左側溶液質量將_______,(填“增大”“減小”或“不變”),且變化了_____克。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com