
科目: 來源: 題型:
【題目】明代《天工開物》記載了“火法”冶煉鋅的方法:“爐甘石十斤,裝載入一泥罐內,…然后逐層用煤炭餅墊盛,其底鋪薪,發火煅紅,…冷淀,毀罐取出,…,即倭鉛也”,現代工業開發了用NH3—NH4Cl水溶液浸出氧化鋅煙灰(主要成分為ZnO 、少量Pb、CuO和As2O3)制取高純鋅的工藝流程如圖所示。
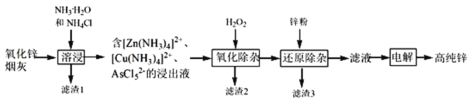
請回答下列問題:
(1)《天工開物》中煉鋅的方法中“泥封”的目的是____________。
(2)濾渣1的主要成份分別是_______(填化學式),“過濾”用到的玻璃儀器是__________。
(3) “溶浸”時,氧化銅參與反應的相關離子方程式是________;“溶浸”時可以適當升高溫度,但不宜過高,其原因是________________。
(4) “氧化除雜”的目的是將AsCl52-轉化為As2O5膠體,再經吸附聚沉除去,溶液始終接近中性,該反應的離子方程式是_____________________。
(5) “電解”含 [Zn(NH3)4]2+的溶液,陰極放電的電極反應式是_________。陽極區產生一種無色無味的氣體,將其通入滴有KSCN的FeCl2溶液中,無明顯現象,該氣體是_______(寫化學式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某校化學研究性學習小組探究足量的鎂與濃硫酸反應。回答下列問題:
Ⅰ.甲同學設計如圖實驗驗證該過程產生的混合氣體中含有![]() 、
、![]() 。
。
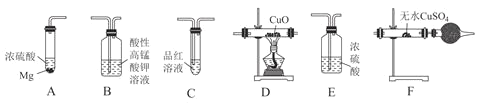
![]() 若按氣體從左到右的流向,各裝置的連接順序是________
若按氣體從左到右的流向,各裝置的連接順序是________![]() 填字母編號
填字母編號![]() 。
。
![]() 已知裝置A中濃硫酸的質量分數為90%,密度ρ=1.47g/mL,該濃硫酸的物質的量濃度為________mol/L。
已知裝置A中濃硫酸的質量分數為90%,密度ρ=1.47g/mL,該濃硫酸的物質的量濃度為________mol/L。
![]() 裝置C的作用是________。
裝置C的作用是________。
![]() 證明混合氣體中含有H2的實驗現象為________。
證明混合氣體中含有H2的實驗現象為________。
Ⅱ.乙同學設計如圖實驗測定混合氣體中SO2的含量。

![]() 溶液可以是________
溶液可以是________![]() 填字母
填字母![]() 。
。
![]() 溶液
溶液
![]() 酸性
酸性![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]()
![]() 溴水
溴水
![]() 步驟
步驟![]() 中洗滌沉淀的操作為________。
中洗滌沉淀的操作為________。
![]() 通過的混合氣體體積為VL(已換算成標準狀況)時,該混合氣體中二氧化硫的含量
通過的混合氣體體積為VL(已換算成標準狀況)時,該混合氣體中二氧化硫的含量![]() 體積分數
體積分數![]() 為________
為________![]() 用含V、m的代數式表示
用含V、m的代數式表示![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】青花瓷,俗稱青花,是中國瓷器的主流品種之一。某同學利用如下方法來粗略測定青花瓷瓶的容積,把![]() NaCl晶體放入到500mL燒杯中,加入200mL蒸餾水,待NaCl完全溶解后,將溶液
NaCl晶體放入到500mL燒杯中,加入200mL蒸餾水,待NaCl完全溶解后,將溶液![]() 包括洗滌液
包括洗滌液![]() 全部轉移到該瓶中,用蒸餾水稀釋至完全充滿容器。從中取出100mL溶液,該溶液恰好能與10mL
全部轉移到該瓶中,用蒸餾水稀釋至完全充滿容器。從中取出100mL溶液,該溶液恰好能與10mL![]() 的
的![]() 溶液完全反應。則下列說法正確的是( )
溶液完全反應。則下列說法正確的是( )
A.該青花瓷瓶的容積約為![]()
B.常溫下,該青花瓷瓶幾乎能容納56kg![]()
C.常溫常壓下,該青花瓷瓶能容納70g![]()
D.標準狀況下,充滿HCl氣體,加滿水后所得溶液物質的量濃度為![]()
查看答案和解析>>
科目: 來源: 題型:
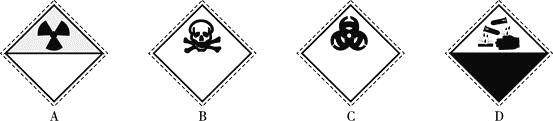
【題目】氰化鈉![]() 是重要的化工原料,易溶于水,易水解生成氰化氫,劇毒物質。常用于電鍍、冶金、有機合成醫藥、絡合劑和掩蔽劑。
是重要的化工原料,易溶于水,易水解生成氰化氫,劇毒物質。常用于電鍍、冶金、有機合成醫藥、絡合劑和掩蔽劑。
![]() 裝氰化鈉
裝氰化鈉![]() 試劑瓶的標簽上應印有下列警示標記中的________
試劑瓶的標簽上應印有下列警示標記中的________![]() 填序號
填序號![]() 。
。
![]() 實驗室用NaCN固體配制NaCN溶液時,為避免其水解,應先將其溶于______________濃溶液,再用蒸餾水稀釋。
實驗室用NaCN固體配制NaCN溶液時,為避免其水解,應先將其溶于______________濃溶液,再用蒸餾水稀釋。
![]() 泄漏時用雙氧水處理以減輕環境污染,處理后生成一種酸式鹽和一種能使濕潤的紅色石蕊試紙變藍的氣體,該反應的離子方程式是__________________________________________。
泄漏時用雙氧水處理以減輕環境污染,處理后生成一種酸式鹽和一種能使濕潤的紅色石蕊試紙變藍的氣體,該反應的離子方程式是__________________________________________。
![]() 化學興趣小組利用:2NH
化學興趣小組利用:2NH![]() 反應原理制備NaCN并檢測其純度。
反應原理制備NaCN并檢測其純度。
實驗一:制備NaCN裝置如圖所示
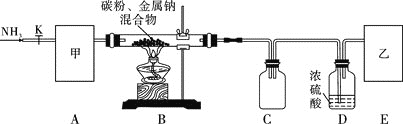
![]() 裝置C的作用是____________。甲可選取下列裝置中的________
裝置C的作用是____________。甲可選取下列裝置中的________![]() 填序號
填序號![]() 。
。

![]() 安裝好實驗儀器,檢查裝置氣密性,取一定量的碳粉與金屬鈉混合,放入硬質玻璃管內;接下來的操作正確的是________
安裝好實驗儀器,檢查裝置氣密性,取一定量的碳粉與金屬鈉混合,放入硬質玻璃管內;接下來的操作正確的是________![]() 填序號
填序號![]() 。
。
A.先打開活塞K,緩緩通入一段時間氨氣后再加熱硬質玻璃管
B.先加熱硬質玻璃管,再打開活塞K,緩緩通入氨氣
C.打開活塞K,一邊緩緩通入氨氣,同時加熱硬質玻璃管
![]() 上述裝置中乙處還需補充的實驗儀器或裝置有__________________。
上述裝置中乙處還需補充的實驗儀器或裝置有__________________。
實驗二:測定產品中氰化鈉的含量
![]() 已知: Ag
已知: Ag![]() ,Ag
,Ag![]() ,AgI呈黃色,且CN
,AgI呈黃色,且CN![]() 優先與Ag
優先與Ag![]() 反應。取制備好的產品
反應。取制備好的產品![]() ,配成
,配成![]() 溶液,取
溶液,取![]() 于錐形瓶中,并滴加
于錐形瓶中,并滴加![]() 滴KI溶液作指示劑,用
滴KI溶液作指示劑,用![]() 的標準AgNO
的標準AgNO![]() 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO![]() 溶液的體積為
溶液的體積為![]() 。滴定終點的現象是____________________________________________________________,產品氰化鈉的純度為________
。滴定終點的現象是____________________________________________________________,產品氰化鈉的純度為________![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】以鉻礦石(主要成分為Cr2O3,還有Al2O3、SiO2等雜質)為原料制取紅礬鈉 (Na2Cr2O7·2H2O)的流程如圖所示。

已知:I.Cr2O3在堿性條件下易被氧化;
II.高溫條件下,Al2O3與Na2CO3發生的反應為:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅燒”時,Cr2O3參加反應的化學方程式為_____。若“煅燒”操作最適宜的溫度是800~900℃,則在實驗室中進行此項操作時,應選擇_____坩堝(填字母)。
a.陶瓷 b.玻璃 c.石英 d.鐵
(2)流程中可循環利用的物質除CO2外還有_____(填化學式)。
(3)“過濾II”所得沉淀主要有______(填化學式)。
(4)由Na2Cr2O7溶液制備紅礬鈉的具體實驗操作有_____,經洗滌、干燥得到紅礬鈉樣品。
(5)“電解”時,利用以下裝置將Na2CrO4溶液轉化為Na2Cr2O7溶液,當a、b均為石墨電極時,a電極的電極反應式為____。若初始加入電解池中的c (Na2CrO4)=1.0mol·L-l,隨著“電解”的進行,當溶液pH=6時,Na2CrO4的轉化率為______(忽略電解過程中溶液體積變化)。

查看答案和解析>>
科目: 來源: 題型:
【題目】水的電離平衡曲線如圖所示,下列說法正確的是
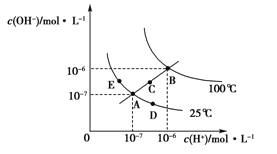
A. 圖中五點KW間的關系:B>C>A=D=E
B. 若從A點到D點,可采用在水中加入少量NaOH的方法
C. 若從A點到C點,可采用溫度不變時在水中加入適量H2SO4 的方法
D. 若處在B點時,將pH=2的硫酸與pH=12的KOH等體積混合后,溶液顯中性
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)實驗室用金屬銅和稀硝酸制取NO的離子方程式____________________________
(2)NO是有毒氣體,某學生為防止污染,用分液漏斗和燒杯裝配了一套簡易的、能隨開隨用、隨關隨停的NO氣體發生裝置,如圖甲所示。
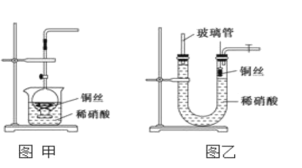
①實驗室若沒有銅絲,而只有小銅粒,在使用上述裝置進行實驗時,可用絲狀材料包裹銅粒以代替銅絲進行實驗,這種絲狀材料的成分可以是________(填序號)。
A.鐵 B.鋁 C.鉑 D.玻璃
②打開分液漏斗的活塞使反應進行,在分液漏斗中實際看到的氣體是紅棕色的,原因是______________________________________(填化學方程式)。
(3)為證明銅絲與稀硝酸反應生成的確實是NO,某學生另設計了一套如圖乙所示的裝置制取NO。反應開始后,可以在U形管右端觀察到無色的NO氣體。
①長玻璃管的作用是________________________________。
②讓反應停止的操作方法及原因是_________________。
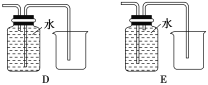
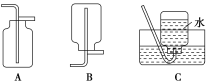
(4)以下收集NO氣體裝置,不合理的是____(填序號)。
查看答案和解析>>
科目: 來源: 題型:
【題目】疊氮化鈉(NaN3)是一種白色劇毒晶體,是汽車安全氣囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱堿性,能與酸發生反應產生具有爆炸性的有毒氣體疊氮化氫。實驗室可利用亞硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)與N2H4、氫氧化鈉溶液混合反應制備疊氮化鈉。
(1)制備亞硝酸叔丁酯
取一定NaNO2溶液與50%硫酸混合,發生反應H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亞硝酸與叔丁醇(t-BuOH)在40 ℃左右制備亞硝酸叔丁酯,試寫出該反應的化學方程式:________________。
(2)制備疊氮化鈉(NaN3)
按如圖所示組裝儀器(加熱裝置略)進行反應,反應方程式為:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①裝置a的名稱是________________;
②該反應需控制溫度在65 ℃,采用的實驗措施是____________________;
③反應后溶液在0 ℃下冷卻至有大量晶體析出后過濾,所得晶體使用無水乙醇洗滌。試解釋低溫下過濾和使用無水乙醇洗滌晶體的原因是______________________________________________。
(3)產率計算
①稱取2.0 g疊氮化鈉試樣,配成100 mL溶液,并量取10.00 mL溶液于錐形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸鈰銨[(NH4)2Ce(NO3)6]溶液40.00 mL[發生的反應為2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假設雜質均不參與反應)。
③充分反應后將溶液稀釋并酸化,滴入2滴鄰菲羅啉指示液,并用0.10 mol·L-1硫酸亞鐵銨[(NH4)2Fe(SO4)2]為標準液,滴定過量的Ce4+,終點時消耗標準溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。計算可知疊氮化鈉的質量分數為__________(保留2位有效數字)。若其他操作及讀數均正確,滴定到終點后,下列操作會導致所測定樣品中疊氮化鈉質量分數偏大的是______(填字母代號)。
A.錐形瓶使用疊氮化鈉溶液潤洗
B.滴加六硝酸鈰銨溶液時,滴加前仰視讀數,滴加后俯視讀數
C.滴加硫酸亞鐵銨標準溶液時,開始時尖嘴處無氣泡,結束時出現氣泡
D.滴定過程中,將掛在錐形瓶壁上的硫酸亞鐵銨標準液滴用蒸餾水沖進瓶內
(4)疊氮化鈉有毒,可以使用次氯酸鈉溶液對含有疊氮化鈉的溶液進行銷毀,反應后溶液堿性明顯增強,且產生無色無味的無毒氣體,試寫出反應的離子方程式:____________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】無水![]() 廣泛用作有機反應催化劑。實驗室采用鎂屑與液溴為原料制備無水
廣泛用作有機反應催化劑。實驗室采用鎂屑與液溴為原料制備無水![]() ,裝置如圖1,主要步驟如下:
,裝置如圖1,主要步驟如下:
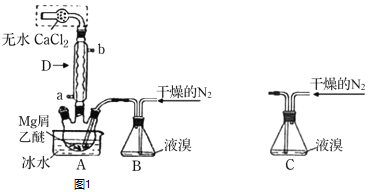
步驟1三頸瓶中裝入10g鎂屑和150mL無水乙醚;裝置B中加入15mL液溴。
步驟2緩慢通入干燥的氮氣,直至溴完全導入三頸瓶中。
步驟3反應完畢后恢復至室溫,過濾,濾液轉移至另一干燥的燒瓶中,冷卻至![]() ,析出晶體,再過濾得三乙醚合溴化鎂粗品。
,析出晶體,再過濾得三乙醚合溴化鎂粗品。
步驟4常溫下用苯溶解粗品,冷卻至![]() ,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至
,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至![]() 分解得無水
分解得無水![]() 產品。
產品。
已知:![]() 和
和![]() 反應劇烈放熱;乙醚
反應劇烈放熱;乙醚![]() 極易揮發;
極易揮發;
![]() 具有強吸水性。
具有強吸水性。
![]()
![]()
![]()
請回答下列問題:
![]() 儀器D的名稱是___________________。冷凝水應該從________
儀器D的名稱是___________________。冷凝水應該從________![]() 填a或
填a或![]() 口通入;
口通入;
![]() 干燥的
干燥的![]() 可將液溴吹出,是因為液溴具有___________的性質;實驗中不能用干燥空氣代替干燥
可將液溴吹出,是因為液溴具有___________的性質;實驗中不能用干燥空氣代替干燥![]() ,原因是___________;
,原因是___________;
![]() 將裝置B改為裝置C,可能會導致的后果是_____________________________;
將裝置B改為裝置C,可能會導致的后果是_____________________________;
![]() 步驟3中,第一次過濾除去的物質是___________________________________;
步驟3中,第一次過濾除去的物質是___________________________________;
![]() 試用平衡移動的原理說明得到三乙醚合溴化鎂后,加熱有利于其分解,得無水
試用平衡移動的原理說明得到三乙醚合溴化鎂后,加熱有利于其分解,得無水![]() 產品的原因:__________________________;
產品的原因:__________________________;
![]() 為測定產品的純度,可用EDTA標準溶液滴定,反應的離子方程式:
為測定產品的純度,可用EDTA標準溶液滴定,反應的離子方程式:![]() ;測定前,先稱取
;測定前,先稱取![]() 無水
無水![]() 產品,溶解后,用0.0500mol/L的EDTA標準溶液滴定至終點,消耗EDTA標準溶液20.00mL,則測得無水
產品,溶解后,用0.0500mol/L的EDTA標準溶液滴定至終點,消耗EDTA標準溶液20.00mL,則測得無水![]() 產品的純度是_________________
產品的純度是_________________![]() 以質量分數表示
以質量分數表示![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】二氧化鈦在一定波長光的照射下,可有效降解甲醛、苯等有機物,效果持久,且自身對人體無害。某課題組研究了溶液的酸堿性對TiO2光催化染料R降解反應的影響,結果如圖所示。下列判斷正確的是

A. 在0~20min之間,pH=7時R的降解速率為0.07mol·L-1·min-1
B. R的起始濃度不同,無法判斷溶液的酸堿性對R的降解速率的影響
C. 二氧化鈦對pH=2的R溶液催化效率好
D. 在0~50 min之間,R的降解百分率pH=2大于pH=7
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com