
【題目】無水![]() 廣泛用作有機反應催化劑。實驗室采用鎂屑與液溴為原料制備無水
廣泛用作有機反應催化劑。實驗室采用鎂屑與液溴為原料制備無水![]() ,裝置如圖1,主要步驟如下:
,裝置如圖1,主要步驟如下:
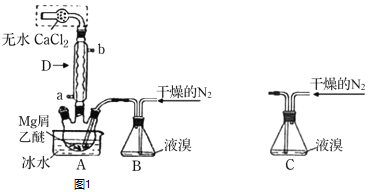
步驟1三頸瓶中裝入10g鎂屑和150mL無水乙醚;裝置B中加入15mL液溴。
步驟2緩慢通入干燥的氮氣,直至溴完全導入三頸瓶中。
步驟3反應完畢后恢復至室溫,過濾,濾液轉移至另一干燥的燒瓶中,冷卻至![]() ,析出晶體,再過濾得三乙醚合溴化鎂粗品。
,析出晶體,再過濾得三乙醚合溴化鎂粗品。
步驟4常溫下用苯溶解粗品,冷卻至![]() ,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至
,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至![]() 分解得無水
分解得無水![]() 產品。
產品。
已知:![]() 和
和![]() 反應劇烈放熱;乙醚
反應劇烈放熱;乙醚![]() 極易揮發;
極易揮發;
![]() 具有強吸水性。
具有強吸水性。
![]()
![]()
![]()
請回答下列問題:
![]() 儀器D的名稱是___________________。冷凝水應該從________
儀器D的名稱是___________________。冷凝水應該從________![]() 填a或
填a或![]() 口通入;
口通入;
![]() 干燥的
干燥的![]() 可將液溴吹出,是因為液溴具有___________的性質;實驗中不能用干燥空氣代替干燥
可將液溴吹出,是因為液溴具有___________的性質;實驗中不能用干燥空氣代替干燥![]() ,原因是___________;
,原因是___________;
![]() 將裝置B改為裝置C,可能會導致的后果是_____________________________;
將裝置B改為裝置C,可能會導致的后果是_____________________________;
![]() 步驟3中,第一次過濾除去的物質是___________________________________;
步驟3中,第一次過濾除去的物質是___________________________________;
![]() 試用平衡移動的原理說明得到三乙醚合溴化鎂后,加熱有利于其分解,得無水
試用平衡移動的原理說明得到三乙醚合溴化鎂后,加熱有利于其分解,得無水![]() 產品的原因:__________________________;
產品的原因:__________________________;
![]() 為測定產品的純度,可用EDTA標準溶液滴定,反應的離子方程式:
為測定產品的純度,可用EDTA標準溶液滴定,反應的離子方程式:![]() ;測定前,先稱取
;測定前,先稱取![]() 無水
無水![]() 產品,溶解后,用0.0500mol/L的EDTA標準溶液滴定至終點,消耗EDTA標準溶液20.00mL,則測得無水
產品,溶解后,用0.0500mol/L的EDTA標準溶液滴定至終點,消耗EDTA標準溶液20.00mL,則測得無水![]() 產品的純度是_________________
產品的純度是_________________![]() 以質量分數表示
以質量分數表示![]() 。
。
【答案】球形冷凝管 a 極易揮發 鎂屑會與空氣中的氧氣反應,生成的MgO阻礙反應的繼續進行 會將液溴擠壓入三頸瓶中,反應加劇大量放熱存在安全隱患 鎂屑 加熱促使乙醚揮發,且逆反應是吸熱反應,加熱后平衡朝有利于三乙醚合溴化鎂分解的方向移動 ![]()
【解析】
(1)根據儀器構造,D為球形冷凝管;冷凝水應該從a口通入;故答案為:球形冷凝管; a;
(2)干燥的![]() 可將液溴吹出,是因為液溴具有極易揮發的性質;實驗中不能用干燥空氣代替干燥
可將液溴吹出,是因為液溴具有極易揮發的性質;實驗中不能用干燥空氣代替干燥![]() ,原因是鎂屑與氧氣反應生成的氧化鎂阻礙Mg和
,原因是鎂屑與氧氣反應生成的氧化鎂阻礙Mg和![]() 的反應;
的反應;
故答案為:極易揮發;鎂屑會與空氣中的氧氣反應,生成的MgO阻礙反應的繼續進行;
(3)將裝置B改為C裝置,當干燥的氮氣通入,會使氣壓變大,將液溴快速壓入三頸瓶,反應過快大量放熱存在安全隱患,裝置B是利用干燥的氮氣將溴蒸氣帶入三頸瓶中,反應容易控制,防止反應過快。
故答案為:會將液溴快速壓入三頸瓶,反應過快大量放熱而存在安全隱患;
(4)步驟3過濾除去的是未反應的鎂屑。
故答案為:鎂屑;
(5)加熱促使乙醚揮發,且逆反應是吸熱反應,加熱后平衡朝有利于三乙醚合溴化鎂分解的方向移動;故答案為:加熱促使乙醚揮發,且逆反應是吸熱反應,加熱后平衡朝有利于三乙醚合溴化鎂分解的方向移動;
(6)依據方程式Mg2++EDTA=EDTA—Mg2+分析,溴化鎂的物質的量![]() ,則溴化鎂的質量為
,則溴化鎂的質量為![]() ,溴化鎂的產品的純度
,溴化鎂的產品的純度![]() 。
。
故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】某溶液中可能含有下列7種離子中的某幾種:Cl-、SO42-、HCO3-、I-、Na+、K+、Fe3+,所含離子的濃度都相等。為了確認溶液的組成,進行了如下實驗:取200 mL上述溶液,加人足量Ba(OH)2溶液中,反應后將沉淀過濾、洗滌、干燥,得沉淀3.4 g。向沉淀中加入過量的鹽酸,充分振蕩后剩余2.33 g沉淀。下列關于該溶液的說法不正確的是
A.只存在SO42-、Cl-、Fe3+三種離子B.—定存在SO42-、Fe3+,可能存在Cl-、I-
C.c(Cl-)=0.05 mol/LD.3.4 g沉淀中含有2種成分
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時,AgX(X=Cl、Br)的溶度積與c(Ag+)和c(X-)的相互關系如下圖所示,其中A線表示AgCl,B線表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列說法正確的是( )

A. c點可表示AgCl的不飽和溶液
B. b點的AgCl溶液加入AgNO3晶體可以變成a點
C. t℃時,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常數K=10-4
AgBr(s)+Cl-(aq)平衡常數K=10-4
D. t℃時,取a點的AgCl溶液和b點AgBr溶液等體積混合,會析出AgBr沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰化物有劇毒,冶金工業會產生大量含氰化物的廢水,其中氰化物以CN-等形式存在于廢水中。某化學小組同學對含氰化物廢水處理進行研究。
Ⅰ.查閱資料:含氰化物的廢水處理方法。
利用強氧化劑將氰化物氧化為無毒物質,如以TiO2為催化劑用NaClO將CN-氧化成CNO-(CN-和CNO-中N元素均為-3價),CNO-在酸性條件下繼續與NaClO反應生成N2、CO2、Cl2等。
Ⅱ.實驗驗證:處理CN-的效果。
化學興趣小組的同學在密閉系統中用如圖裝置進行實驗,以測定CN-被處理的百分率,實驗步驟如下:
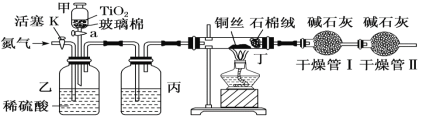
步驟1:取一定量廢水進行加熱蒸發、濃縮。
步驟2:取濃縮后含CN-的廢水與過量NaClO溶液的混合液共200 mL(設其中CN-的濃度為0.2 mol·L-1)倒入甲中,塞上橡皮塞。
步驟3:點燃酒精燈對丁裝置加熱。
步驟4:打開甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,關閉活塞。
步驟5:打開活塞K,通一段時間N2,關閉活塞K。
步驟6:實驗完成后測定干燥管Ⅰ(含堿石灰)的質量m2[實驗前干燥管Ⅰ(含堿石灰)的質量m1]。
回答下列問題:
(1)在處理方法中,在酸性條件下NaClO和CNO-反應的離子方程式為:___________。
(2)對丁裝置加熱放在步驟3進行的原因是:___________。
(3)丙裝置中的試劑是:___________。
(4)裝置中石棉絨作用為:___________。
(5)干燥管Ⅱ的作用是:_____________________________。
(6)請簡要說明實驗中通入N2的目的是:______________________________。
(7)若干燥管Ⅰ中堿石灰增重1.408 g,則該實驗中測得CN-被處理的百分率為:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫化阿托醛![]() 是一種重要的化工原料,其合成路線如下:
是一種重要的化工原料,其合成路線如下:
(1)氫化阿托醛被催化氧化后的含氧官能團的名稱是____________.
(2)在合成路線上②③的反應類型分別為②_____________③________________.
(3)反應④發生的條件是_____________________.
(4)由![]() 反應的化學方程式為_______________________________
反應的化學方程式為_______________________________
(5)1mol氫化阿托醛最多可和____mol氫氣加成,1mol氫化阿托醛發生銀鏡反應可生成________molAg.
(6)D與有機物X在一定條件下可生成一種相對分子質量為178的酯類物質,則X的結構簡式為________.D有多種同分異構體,能滿足苯環上有兩個取代基,且能使FeCl3溶液顯紫色的同分異構體有______種.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰化鈉![]() 是重要的化工原料,易溶于水,易水解生成氰化氫,劇毒物質。常用于電鍍、冶金、有機合成醫藥、絡合劑和掩蔽劑。
是重要的化工原料,易溶于水,易水解生成氰化氫,劇毒物質。常用于電鍍、冶金、有機合成醫藥、絡合劑和掩蔽劑。
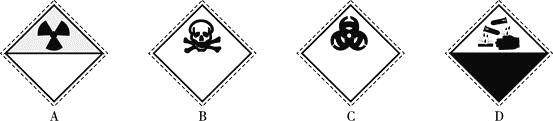
![]() 裝氰化鈉
裝氰化鈉![]() 試劑瓶的標簽上應印有下列警示標記中的________
試劑瓶的標簽上應印有下列警示標記中的________![]() 填序號
填序號![]() 。
。
![]() 實驗室用NaCN固體配制NaCN溶液時,為避免其水解,應先將其溶于______________濃溶液,再用蒸餾水稀釋。
實驗室用NaCN固體配制NaCN溶液時,為避免其水解,應先將其溶于______________濃溶液,再用蒸餾水稀釋。
![]() 泄漏時用雙氧水處理以減輕環境污染,處理后生成一種酸式鹽和一種能使濕潤的紅色石蕊試紙變藍的氣體,該反應的離子方程式是__________________________________________。
泄漏時用雙氧水處理以減輕環境污染,處理后生成一種酸式鹽和一種能使濕潤的紅色石蕊試紙變藍的氣體,該反應的離子方程式是__________________________________________。
![]() 化學興趣小組利用:2NH
化學興趣小組利用:2NH![]() 反應原理制備NaCN并檢測其純度。
反應原理制備NaCN并檢測其純度。
實驗一:制備NaCN裝置如圖所示
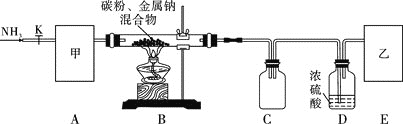
![]() 裝置C的作用是____________。甲可選取下列裝置中的________
裝置C的作用是____________。甲可選取下列裝置中的________![]() 填序號
填序號![]() 。
。

![]() 安裝好實驗儀器,檢查裝置氣密性,取一定量的碳粉與金屬鈉混合,放入硬質玻璃管內;接下來的操作正確的是________
安裝好實驗儀器,檢查裝置氣密性,取一定量的碳粉與金屬鈉混合,放入硬質玻璃管內;接下來的操作正確的是________![]() 填序號
填序號![]() 。
。
A.先打開活塞K,緩緩通入一段時間氨氣后再加熱硬質玻璃管
B.先加熱硬質玻璃管,再打開活塞K,緩緩通入氨氣
C.打開活塞K,一邊緩緩通入氨氣,同時加熱硬質玻璃管
![]() 上述裝置中乙處還需補充的實驗儀器或裝置有__________________。
上述裝置中乙處還需補充的實驗儀器或裝置有__________________。
實驗二:測定產品中氰化鈉的含量
![]() 已知: Ag
已知: Ag![]() ,Ag
,Ag![]() ,AgI呈黃色,且CN
,AgI呈黃色,且CN![]() 優先與Ag
優先與Ag![]() 反應。取制備好的產品
反應。取制備好的產品![]() ,配成
,配成![]() 溶液,取
溶液,取![]() 于錐形瓶中,并滴加
于錐形瓶中,并滴加![]() 滴KI溶液作指示劑,用
滴KI溶液作指示劑,用![]() 的標準AgNO
的標準AgNO![]() 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO![]() 溶液的體積為
溶液的體積為![]() 。滴定終點的現象是____________________________________________________________,產品氰化鈉的純度為________
。滴定終點的現象是____________________________________________________________,產品氰化鈉的純度為________![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據雜化軌道理論和價層電子對互斥模型,判斷下列分子或者離子的空間構型正確的是 ( )
選項 | 分子式 | 中心原子雜化方式 | 價層電子對互斥模型 | 分子或離子的立體構型 |
A | SO2 | sp | 直線形 | 直線形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角錐形 | 三角錐形 |
D | CH4 | sp3 | 正四面體形 | 正四面體形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,向20mL 0.1mol/L的CH3COOH溶液中不斷滴加0.1mol/L的NaOH溶液,溶液的pH變化曲線如圖所示,在滴定過程中,下列關于溶液中離子濃度大小關系的描述不正確的是( )
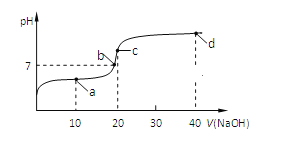
A. a點時:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b點時:c(Na+)<c(CH3COO-)
C. c點時:c(OH-)=c(CH3COOH)+ c(H+)
D. d點時:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在溫度一定的條件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密閉容器中反應并達到平衡時,混合氣體的平均摩爾質量為
2NH3(g)在密閉容器中反應并達到平衡時,混合氣體的平均摩爾質量為![]() ,N2與NH3的濃度均為c mol·L1。若將容器的體積壓縮為原來的1/2,當達到新的平衡時,下列說法中不正確的是
,N2與NH3的濃度均為c mol·L1。若將容器的體積壓縮為原來的1/2,當達到新的平衡時,下列說法中不正確的是
A.新的平衡體系中,N2的濃度小于2c mol·L1大于c mol·L1
B.新的平衡體系中,NH3的濃度小于2c mol·L1大于c mol·L1
C.新的平衡體系中,混合體的平均摩爾質量大于![]()
D.新的平衡體系中,氣體密度是原平衡體系的2倍
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com