
【題目】氫化阿托醛![]() 是一種重要的化工原料,其合成路線如下:
是一種重要的化工原料,其合成路線如下:
(1)氫化阿托醛被催化氧化后的含氧官能團的名稱是____________.
(2)在合成路線上②③的反應類型分別為②_____________③________________.
(3)反應④發(fā)生的條件是_____________________.
(4)由![]() 反應的化學方程式為_______________________________
反應的化學方程式為_______________________________
(5)1mol氫化阿托醛最多可和____mol氫氣加成,1mol氫化阿托醛發(fā)生銀鏡反應可生成________molAg.
(6)D與有機物X在一定條件下可生成一種相對分子質(zhì)量為178的酯類物質(zhì),則X的結構簡式為________.D有多種同分異構體,能滿足苯環(huán)上有兩個取代基,且能使FeCl3溶液顯紫色的同分異構體有______種.
【答案】羧基 消去反應 加成反應 NaOH水溶液、加熱 ![]() 4 2 CH3COOH 6
4 2 CH3COOH 6
【解析】
由流程可知,苯和丙烯發(fā)生加成反應生異丙苯;異丙苯發(fā)生氯代反應生成A;A發(fā)生消去反應生成2-苯丙烯;2-苯丙烯再與氯化氫發(fā)生加成反應生成1-氯-2-苯丙烷;1-氯-2-苯丙烷發(fā)生水解反應生成2-苯-1-丙醇;2-苯-1-丙醇發(fā)生氧化反應生成氫化阿托醛。
(1)氫化阿托醛中的醛基被催化氧化為羧基,所以氫化阿托醛被氧化后的官能團是羧基;
(2)根據(jù)流程圖可知,異丙苯發(fā)生氯代后生成的A中含有Cl原子,A發(fā)生消去反應生成烯烴,烯烴再與HCl發(fā)生加成反應生成鹵代烴,所以②③的反應類型分別為消去反應、加成反應;
(3)D由鹵代烴轉化而來,其又發(fā)生反應轉化為氫化阿托醛,官能團變?yōu)槿┗瑒tD應是醇類,其被氧化得到醛,所以反應④應發(fā)生了鹵代烴的水解反應,則其條件為NaOH的水溶液、加熱;
(4)由D在Cu作催化劑、加熱條件下與氧氣發(fā)生氧化反應生成氫化阿托醛和水,化學方程式是![]() ;
;
(5)氫化阿托醛中的苯環(huán)和醛基均能與氫氣發(fā)生加成反應,所以1mol氫化阿托醛最多與4mol氫氣發(fā)生加成反應;
(6)D的相對分子質(zhì)量是136,與X發(fā)生酯化反應生成相對分子質(zhì)量為178的酯類物質(zhì),則X屬于羧酸,根據(jù)質(zhì)量守恒定律,該羧酸的相對分子質(zhì)量是178+18-136=60,所以X是乙酸,結構簡式為CH3COOH;D的同分異構體中,苯環(huán)有2個取代基,且苯環(huán)含有酚羥基的化合物中,2個取代基是酚羥基與丙基(或異丙基),這2個取代基在苯環(huán)上的排列方式有鄰、間、對3種,所以符合題意的D的同分異構體有6種。


科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是 ![]() 。
。
A.![]() 溶于足量稀
溶于足量稀![]() :
:![]()
B.用食醋檢驗牙膏中碳酸鈣的存在:![]()
C.![]() 酸性溶液放在空氣中變質(zhì):
酸性溶液放在空氣中變質(zhì):![]()
D.電解![]() 水溶液的離子方程式: 2Cl-+2H2O
水溶液的離子方程式: 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯![]() 作為一種高效強氧化劑,已被聯(lián)合國世界衛(wèi)生組織
作為一種高效強氧化劑,已被聯(lián)合國世界衛(wèi)生組織![]() 列為AⅠ級安全消毒劑。常溫下二氧化氯為黃綠色或橘黃色氣體,性質(zhì)非常不穩(wěn)定,溫度過高或水溶液中
列為AⅠ級安全消毒劑。常溫下二氧化氯為黃綠色或橘黃色氣體,性質(zhì)非常不穩(wěn)定,溫度過高或水溶液中![]() 的質(zhì)量分數(shù)高于
的質(zhì)量分數(shù)高于![]() 等均有可能引起爆炸,易與堿液反應生成鹽和水。
等均有可能引起爆炸,易與堿液反應生成鹽和水。
![]() 某研究小組設計如圖所示實驗制備
某研究小組設計如圖所示實驗制備![]() 溶液,其反應的化學方程式為
溶液,其反應的化學方程式為![]() 。
。
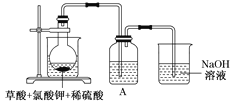
![]() 在反應開始之前將燒杯中的水加熱到
在反應開始之前將燒杯中的水加熱到![]() ,然后停止加熱,并使其溫度保持在
,然后停止加熱,并使其溫度保持在![]() 之間。控制溫度的目的是___________,圖中裝置中缺少的一種必需的玻璃儀器是_______________________。
之間。控制溫度的目的是___________,圖中裝置中缺少的一種必需的玻璃儀器是_______________________。
![]() 裝置A用于溶解產(chǎn)生的二氧化氯氣體,其中最好盛放________
裝置A用于溶解產(chǎn)生的二氧化氯氣體,其中最好盛放________![]() 填標號
填標號![]() 。
。
a.20mL60℃的溫水 b.100mL冰水 c.100mL飽和食鹽水 d.100mL沸水
![]() 在燒瓶中加入12.25gKClO3和9g草酸
在燒瓶中加入12.25gKClO3和9g草酸![]() ,然后再加入足量的稀硫酸,水浴加熱,反應后生成
,然后再加入足量的稀硫酸,水浴加熱,反應后生成![]() 的質(zhì)量為________。
的質(zhì)量為________。
![]() 用
用![]() 處理過的飲用水
處理過的飲用水![]() 為
為![]() 常含有一定量對人體不利的亞氯酸根離子
常含有一定量對人體不利的亞氯酸根離子![]() 。飲用水中
。飲用水中![]() 、
、![]() 的含量可用連續(xù)碘量法進行測定,實驗步驟如下:
的含量可用連續(xù)碘量法進行測定,實驗步驟如下:
步驟1:準確量取一定體積的水樣加入錐形瓶中;
步驟2:調(diào)節(jié)水樣的pH至![]() ;
;
步驟3:加入足量的KI晶體;
步驟4:加入少量指示劑,用一定濃度的![]() 溶液滴定至終點;
溶液滴定至終點;
步驟5:再調(diào)節(jié)溶液的![]() ;
;
步驟6:繼續(xù)用相同濃度的![]() 溶液滴定至終點。
溶液滴定至終點。
![]() 步驟1中若要量取20.00mL水樣,則應選用的儀器是____________________。
步驟1中若要量取20.00mL水樣,則應選用的儀器是____________________。
![]() 步驟
步驟![]() 的目的是測定水樣中
的目的是測定水樣中![]() 的含量,其反應的化學方程式為2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,則步驟4中加入的指示劑為______________,滴定達到終點時溶液的顏色變化為______________。
的含量,其反應的化學方程式為2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,則步驟4中加入的指示劑為______________,滴定達到終點時溶液的顏色變化為______________。
![]() 步驟5的目的是使
步驟5的目的是使![]() 將溶液中的
將溶液中的![]() 還原為
還原為![]() 以測定其含量,該反應的離子方程式為____________________________。
以測定其含量,該反應的離子方程式為____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法錯誤的是( )
A.![]() 和
和![]() 不屬于同分異構體
不屬于同分異構體
B.質(zhì)量相同的![]() 和
和![]() 完全燃燒時消耗氧氣的質(zhì)量較少的是
完全燃燒時消耗氧氣的質(zhì)量較少的是![]()
C.連接四個不同基團的碳原子為“手性碳原子”,![]() 含有兩個手性碳原子
含有兩個手性碳原子
D.標準狀況下![]() L溴乙烷所含化學鍵總數(shù)為
L溴乙烷所含化學鍵總數(shù)為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水![]() 廣泛用作有機反應催化劑。實驗室采用鎂屑與液溴為原料制備無水
廣泛用作有機反應催化劑。實驗室采用鎂屑與液溴為原料制備無水![]() ,裝置如圖1,主要步驟如下:
,裝置如圖1,主要步驟如下:
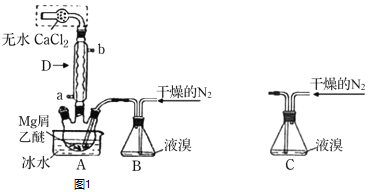
步驟1三頸瓶中裝入10g鎂屑和150mL無水乙醚;裝置B中加入15mL液溴。
步驟2緩慢通入干燥的氮氣,直至溴完全導入三頸瓶中。
步驟3反應完畢后恢復至室溫,過濾,濾液轉移至另一干燥的燒瓶中,冷卻至![]() ,析出晶體,再過濾得三乙醚合溴化鎂粗品。
,析出晶體,再過濾得三乙醚合溴化鎂粗品。
步驟4常溫下用苯溶解粗品,冷卻至![]() ,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至
,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至![]() 分解得無水
分解得無水![]() 產(chǎn)品。
產(chǎn)品。
已知:![]() 和
和![]() 反應劇烈放熱;乙醚
反應劇烈放熱;乙醚![]() 極易揮發(fā);
極易揮發(fā);
![]() 具有強吸水性。
具有強吸水性。
![]()
![]()
![]()
請回答下列問題:
![]() 儀器D的名稱是___________________。冷凝水應該從________
儀器D的名稱是___________________。冷凝水應該從________![]() 填a或
填a或![]() 口通入;
口通入;
![]() 干燥的
干燥的![]() 可將液溴吹出,是因為液溴具有___________的性質(zhì);實驗中不能用干燥空氣代替干燥
可將液溴吹出,是因為液溴具有___________的性質(zhì);實驗中不能用干燥空氣代替干燥![]() ,原因是___________;
,原因是___________;
![]() 將裝置B改為裝置C,可能會導致的后果是_____________________________;
將裝置B改為裝置C,可能會導致的后果是_____________________________;
![]() 步驟3中,第一次過濾除去的物質(zhì)是___________________________________;
步驟3中,第一次過濾除去的物質(zhì)是___________________________________;
![]() 試用平衡移動的原理說明得到三乙醚合溴化鎂后,加熱有利于其分解,得無水
試用平衡移動的原理說明得到三乙醚合溴化鎂后,加熱有利于其分解,得無水![]() 產(chǎn)品的原因:__________________________;
產(chǎn)品的原因:__________________________;
![]() 為測定產(chǎn)品的純度,可用EDTA標準溶液滴定,反應的離子方程式:
為測定產(chǎn)品的純度,可用EDTA標準溶液滴定,反應的離子方程式:![]() ;測定前,先稱取
;測定前,先稱取![]() 無水
無水![]() 產(chǎn)品,溶解后,用0.0500mol/L的EDTA標準溶液滴定至終點,消耗EDTA標準溶液20.00mL,則測得無水
產(chǎn)品,溶解后,用0.0500mol/L的EDTA標準溶液滴定至終點,消耗EDTA標準溶液20.00mL,則測得無水![]() 產(chǎn)品的純度是_________________
產(chǎn)品的純度是_________________![]() 以質(zhì)量分數(shù)表示
以質(zhì)量分數(shù)表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學研究性學習小組探究足量的鎂與濃硫酸反應。回答下列問題:
Ⅰ.甲同學設計如圖實驗驗證該過程產(chǎn)生的混合氣體中含有![]() 、
、![]() 。
。
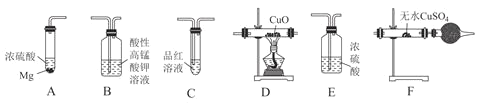
![]() 若按氣體從左到右的流向,各裝置的連接順序是________
若按氣體從左到右的流向,各裝置的連接順序是________![]() 填字母編號
填字母編號![]() 。
。
![]() 已知裝置A中濃硫酸的質(zhì)量分數(shù)為90%,密度ρ=1.47g/mL,該濃硫酸的物質(zhì)的量濃度為________mol/L。
已知裝置A中濃硫酸的質(zhì)量分數(shù)為90%,密度ρ=1.47g/mL,該濃硫酸的物質(zhì)的量濃度為________mol/L。
![]() 裝置C的作用是________。
裝置C的作用是________。
![]() 證明混合氣體中含有H2的實驗現(xiàn)象為________。
證明混合氣體中含有H2的實驗現(xiàn)象為________。
Ⅱ.乙同學設計如圖實驗測定混合氣體中SO2的含量。

![]() 溶液可以是________
溶液可以是________![]() 填字母
填字母![]() 。
。
![]() 溶液
溶液
![]() 酸性
酸性![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]()
![]() 溴水
溴水
![]() 步驟
步驟![]() 中洗滌沉淀的操作為________。
中洗滌沉淀的操作為________。
![]() 通過的混合氣體體積為VL(已換算成標準狀況)時,該混合氣體中二氧化硫的含量
通過的混合氣體體積為VL(已換算成標準狀況)時,該混合氣體中二氧化硫的含量![]() 體積分數(shù)
體積分數(shù)![]() 為________
為________![]() 用含V、m的代數(shù)式表示
用含V、m的代數(shù)式表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項敘述中,正確的是
A.價電子排布為ns1的元素,不一定是s區(qū)元素
B.配合物Fe(CO)n內(nèi)中心原子價電子數(shù)與配體提供電子總數(shù)之和為18,則n=5
C.光鹵氣(COCl2)、甲醛分子的立體構型和鍵角均相同
D.某氣態(tài)團簇分子結構如圖所示,該氣態(tài)團簇分子的分子式為EF或FE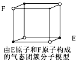
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知0.1mol/LH2SO4在水中的第一步電離是完全的,第二步電離并不完全。常溫下有0.1mol/L的以下幾種溶液的電離度(即已經(jīng)電離的分子數(shù)占原來分子總數(shù)的百分數(shù))如下表,回答下列問題:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)寫出H2SO4在水中的電離方程式___。
(2)若將10mL題設條件下的NaHSO4溶液與0.1mol/LNaOH溶液等體積混合,則混合后溶液中離子濃度由大到小順序為___。
(3)根據(jù)題設條件計算CH3COOH的電離常數(shù)Ka=___。若常溫下,將bmol·L–1的CH3COONa液與0.01mol·L–1的鹽酸等體積混合,反應達平衡時,測得溶液的pH=7,用含b的代數(shù)式表示CH3COOH的電離常數(shù)Ka=___。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com