
科目: 來源: 題型:
【題目】已知A與![]() 、CO形成B,B能發生銀鏡反應,C分子中只有一種氫,相關物質轉化關系如下
、CO形成B,B能發生銀鏡反應,C分子中只有一種氫,相關物質轉化關系如下![]() 含有相同官能團的有機物通常具有相似的化學性質
含有相同官能團的有機物通常具有相似的化學性質![]() :
:
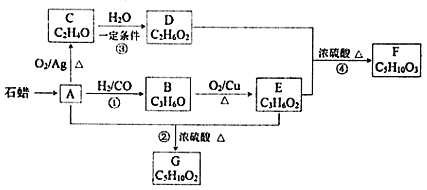
請回答:
![]() 有機物C的結構簡式是______,反應②的反應類型是______。
有機物C的結構簡式是______,反應②的反應類型是______。
![]() 寫出一定條件下發生反應①的化學方程式______。
寫出一定條件下發生反應①的化學方程式______。
![]() 下列說法不正確的是______
下列說法不正確的是______![]() 填字母
填字母![]() 。
。
A.化合物A屬于烴
B.化合物D含有兩種官能團
C.用金屬鈉無法鑒別化合物F、G
查看答案和解析>>
科目: 來源: 題型:
【題目】將6.8g的X完全燃燒生成3.6g的H2O和8.96L(標準狀況)的CO2。X的核磁共振氫譜有4個峰且面積之比為3:2:2:1。X分子中只含一個苯環且苯環上只有一個取代基,其質譜圖、核磁共振氫譜與紅外光譜如圖。關于X的下列敘述正確的是
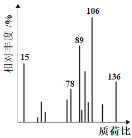
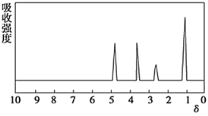
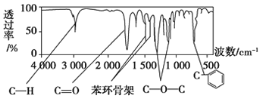
A.化合物X的相對分子質量為106
B.X分子中所有的原子在同一個平面上
C.符合題中X分子結構特征的有機物有3種
D.化合物X分子中含有官能團的名稱為酯基
查看答案和解析>>
科目: 來源: 題型:
【題目】常見有機物間的轉化關系如圖所示(以下變化中,某些反應條件及產物未標明)。A是天然有機高分子化合物,D是一種重要的化工原料。在相同條件下,G蒸氣密度是氫氣的44倍。
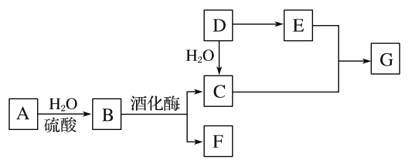
(1)D中官能團的名稱:______________________________________。
(2)C和E反應的化學方程式:________________________。
(3)檢驗A轉化過程中有B生成,先中和水解液,再需要加入的試劑是________________________________。
(4)某烴X的相對分子質量是D、F之和,分子中碳與氫的質量之比是5∶1。下列說法正確的是________(填字母)。
A.X 不溶于水,與甲烷互為同系物
B.X性質穩定,高溫下不會分解
C.X不存在含有3個甲基的同分異構體
D.X可能和溴水發生加成反應
查看答案和解析>>
科目: 來源: 題型:
【題目】某100mL溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干種,取該溶液進行連續實驗,實驗過程如圖所示
中的若干種,取該溶液進行連續實驗,實驗過程如圖所示![]() 所加試劑均過量,氣體全部逸出
所加試劑均過量,氣體全部逸出![]()

下列說法一定正確的是![]()
A.溶液中一定含有![]() ,
,![]() 濃度是
濃度是![]()
B.溶液中只有![]() 、
、![]() 、
、![]() 離子
離子
C.溶液中可能含有![]() ,一定沒有
,一定沒有![]()
D.取原溶液少許加入硝酸酸化的![]() 溶液檢驗是否有
溶液檢驗是否有![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】分析下列反應并按要求填空。
(1) 鐵與氯氣在一定條件反應,寫出化學反應方程式 _________________其中氧化劑是____________;發生氧化反應的是____________,當1molFe反應時轉移_____mol電子
(2)取少量鐵與氯氣反應得到的固體溶于水,分裝在兩只試管中,若向其中一支試管滴加KSCN溶液,則溶液變成_____色。向另一支試管滴加NaOH溶液,現象為_________________ 離子反應的方程式為______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】漢黃芩素是傳統中草藥黃芩的有效成分之一,對腫瘤細胞的殺傷有獨特作用。下列有關漢黃芩素的敘述正確的是
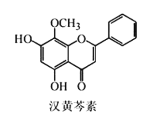
A.漢黃芩素的分子式為C16H13O5
B.該物質能與Na2CO3溶液反應,遇FeCl3溶液顯色
C.1mol該物質與溴水反應最多可與2molBr2發生加成反應
D.該分子最多能與6molH2發生加成反應
查看答案和解析>>
科目: 來源: 題型:
【題目】我國是世界上最大的鎢儲藏國,金屬鎢可用于制造燈絲、合金鋼和光學儀器,有“光明使者”的美譽,現以白鎢礦(主要成分為CaWO4,還含有二氧化硅、氧化鐵等雜質)為原料冶煉高純度金屬鎢,工業流程如圖:
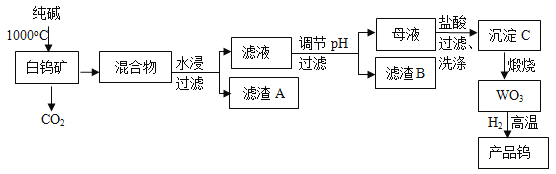
已知:①鎢酸酸性很弱,難溶于水;
②完全沉淀離子的pH值:SiO32﹣為8,WO42﹣為5;
③碳和金屬鎢在高溫下會反應生成碳化鎢。
回答下列問題:
(1)工業上生產純堿常先制得碳酸氫鈉,此法叫“聯堿法”,為我國化工專家侯德榜創立,即向飽和食鹽水中先通入NH3,再通入CO2,最終生成碳酸氫鈉晶體和氯化銨溶液,寫出該化學反應方程式:____。
(2)流程中白鎢礦CaWO4和純堿發生的化學反應方程式是:____。
(3)濾渣B的主要成分是(寫化學式)___。調節pH可選用的試劑是:__(填選項)。
A.氨水 B.鹽酸 C.NaOH溶液 D.Na2CO3溶液
(4)檢驗沉淀C已經洗滌干凈的操作是____。
(5)為了獲得可以拉制燈絲的高純度金屬鎢,不宜用碳而必須用氫氣作還原劑的原因是:___。
(6)將氫氧化鈣加入鎢酸鈉堿性溶液中可得到鎢酸鈣,已知某溫度時,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,當溶液中WO42﹣恰好沉淀完全(離子濃度等于10﹣5mol/L)時,溶液中c(OH﹣)=____。
查看答案和解析>>
科目: 來源: 題型:
【題目】向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解, 放出1. 344 L NO(標準狀況),往所得溶液中加入KSCN溶液,無紅色出現。若用足量的CO在加熱下還原相同質量的混合物,能得到鐵的物質的量為( )
A.0. 24 molB.0. 21 molC.0. 16 molD.0. 14 mol
查看答案和解析>>
科目: 來源: 題型:
【題目】在一個絕熱的恒容密閉容器中,可逆反應![]() 達到平衡狀態的標志是( )
達到平衡狀態的標志是( )
①![]() ②各組分的物質的量不變 ③體系的壓強不再發生變化 ④混合氣體的密度不變 ⑤體系的溫度不再發生變化 ⑥
②各組分的物質的量不變 ③體系的壓強不再發生變化 ④混合氣體的密度不變 ⑤體系的溫度不再發生變化 ⑥![]() ⑦3mol H-H鍵斷裂的同時有2mol N-H鍵也斷裂
⑦3mol H-H鍵斷裂的同時有2mol N-H鍵也斷裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:CH3COOH![]() CH3COO-+H+達到電離平衡時,電離平衡常數可以表示為Ka=
CH3COO-+H+達到電離平衡時,電離平衡常數可以表示為Ka=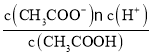 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-達到水解平衡時,水解平衡常數可以表示為Kh=
CH3COOH+OH-達到水解平衡時,水解平衡常數可以表示為Kh=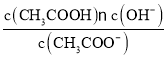 (式中各粒子濃度均為平衡時濃度)。
(式中各粒子濃度均為平衡時濃度)。
(1)對于任意弱電解質來講,其電離平衡常數Ka、對應離子的水解平衡常數Kh以及水的離子積常數KW的關系是____________________,由此可以推斷,弱電解質的電離程度越小,其對應離子的水解程度____________。
(2)由于CH3COOH的電離程度很小,計算時可將CH3COOH的平衡濃度看成是CH3COOH溶液的濃度,則c mol·L-1的CH3COOH溶液中c(H+)=______(不為0)。
(3)現用某未知濃度(設為c′)的CH3COOH溶液及其他儀器、藥品,通過實驗測定一定溫度下CH3COOH的電離平衡常數,需測定的數據有(用簡要的文字說明):
①實驗時的溫度;②____________;③用______________(填一種實驗方法)測定溶液濃度c′。
(4)已知常溫下CN-的水解常數Kh=1.61×10-5。常溫下,含等物質的量濃度的HCN與NaCN的混合溶液顯__________(填“酸”、“堿”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。該溶液中各離子濃度由大到小的順序為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com