
科目: 來源: 題型:
【題目】合金應用廣泛,鎳銅是重要的合金元素,如鑭鎳合金、銅鎳合金、鋁鎳合金等。
![]() 基態銅原子的外圍電子排布式為______,K和Cu屬于同一周期,金屬K的熔點比金屬Cu______
基態銅原子的外圍電子排布式為______,K和Cu屬于同一周期,金屬K的熔點比金屬Cu______![]() 填“高”或“低”
填“高”或“低”![]() ,原因是______。
,原因是______。
![]() 在
在![]() 溶液中滴加稀氨水能形成配位化合物
溶液中滴加稀氨水能形成配位化合物![]() 。
。
![]() 、N、O、Ni的電負性由小到大的順序為______;
、N、O、Ni的電負性由小到大的順序為______;
![]() SO42-中S原子的雜化類型是______。
SO42-中S原子的雜化類型是______。
![]() SO42-與互為等電子體的分子的化學式
SO42-與互為等電子體的分子的化學式![]() 寫出一種即可
寫出一種即可![]() ______;
______;
![]() 工業上,采用反應
工業上,采用反應![]() 提純粗鎳。推測
提純粗鎳。推測![]() 晶體中存在的作用力有______。
晶體中存在的作用力有______。
![]() 非極性鍵
非極性鍵![]() 極性鍵
極性鍵![]() 范德華力
范德華力![]() 離子鍵
離子鍵![]() 配位鍵
配位鍵
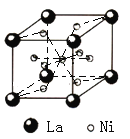
![]() 鑭鎳合金的晶胞如圖1所示,鎳原子除了1個在體心外,其余都在面上。該合金中鑭原子和鎳原子的個數比為______。
鑭鎳合金的晶胞如圖1所示,鎳原子除了1個在體心外,其余都在面上。該合金中鑭原子和鎳原子的個數比為______。
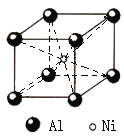
![]() 鋁鎳合金的晶胞如圖所示。已知:鋁鎳合金的密度為
鋁鎳合金的晶胞如圖所示。已知:鋁鎳合金的密度為![]() ,
,![]() 代表阿伏加德羅常數的數值,則鎳、鋁的最短核間距
代表阿伏加德羅常數的數值,則鎳、鋁的最短核間距![]() 為______。
為______。
查看答案和解析>>
科目: 來源: 題型:
【題目】元素周期表中,除了22種非金屬元素外,其余的都是金屬,請根據元素周期表回答下列問題:
I.(1)基態氮原子核外共有_______種運動狀態不相同的電子,該原子核外電子排布中電子在能量最低的軌道呈_______形,用n表示能層,氟元素所在族的外圍電子排布式為______________。
(2)在元素周期表中,某些主族元素與下方的主族元素的性質有些相似,被稱為“對角線規則”,如下表:

根據“對角線規則”寫出Be(OH)2與NaOH反應的離子方程式______________,硼酸(H3BO3)是一種具有片層結構的白色晶體,層內的H3BO3分子間通過氫鍵相連(如圖)。含1mol H3BO3的晶體中有__________mol氫鍵,H3BO3中B原子的雜化類型為_____________。

(3)以第二周期為例,除Be、N外,其它元素的第一電離能從左到右逐漸增大的原因是____________________________________________________。
II.近年來鐵及其化合物在工農業中有廣闊的應用前景。
(4)鐵的一種絡離子[Fe(CN)6]4-中Fe2+的配位數為6,該絡離子中不存在______(填序號)。
A.共價鍵 B.非極性鍵 C.配位鍵 D.δ鍵 E.π鍵
(5)AlCl3的熔點比NaCl熔點低的原因是____________________________________。
(6)一種Al-Fe合金的立體晶胞如圖所示。若晶體的密度為ρ gcm-3,則此合金中最近的兩個Fe原子之間的距離為__________cm(用含ρ的代數式表示)。

查看答案和解析>>
科目: 來源: 題型:
【題目】(1)只用水就能鑒別的一組物質是______
a.苯、乙酸、四氯化碳 b.乙醇、乙醛、乙酸
c.乙醛、乙二醇、硝基苯 d.苯酚、乙醇、甘油
(2)現有化合物:甲: 乙:
乙: 丙:
丙:
①請寫出丙中含氧官能團的名稱:____。
②請判別上述哪些化合物互為同分異構體:____(填代號)。
(3)A和B兩種物質的分子式都是C7H8O芳香族化合物,它們都能跟金屬Na反應放出H2;A不溶于NaOH溶液而B能溶于NaOH溶液,B能使FeCl3溶液顯紫色,A不能;B苯環上的一溴代物有兩種結構。則A和B的名稱及結構簡式為:A_____,B_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法中,正確的是( )
A.含有羥基的化合物一定屬于醇類
B.代表醇類的官能團是與非苯環上的碳相連的羥基
C.酚類和醇類具有相同的官能團,因而具有相同的化學性質
D.分子內有苯環和羥基的化合物一定是酚類
查看答案和解析>>
科目: 來源: 題型:
【題目】一定溫度下,在三個容積均為2.0 L的恒容密閉容器中發生反應:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物質的量濃度與反應溫度如下表所示:
N2(g)+2CO2(g)。各容器中起始物質的量濃度與反應溫度如下表所示:
容器 | 溫度/℃ | 起始物質的量濃度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
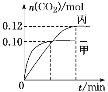
反應過程中甲、丙容器中CO2的物質的量隨時間變化關系如圖所示。下列說法正確的是
A.該反應的正反應為放熱反應,平衡常數K(T1)<K(T2)
B.乙容器中反應達到平衡時,N2的轉化率小于40%
C.達到平衡時,乙容器中的壓強一定大于甲容器的2倍
D.丙容器中反應達到平衡后,再充入0.10 mol NO和0.10 mol CO2,此時υ(正)<υ(逆)
查看答案和解析>>
科目: 來源: 題型:
【題目】油脂是油與脂肪的總稱,它是多種高級脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途與其含有的碳碳不飽和鍵(![]() )有關的是
)有關的是
A. 衣服上的油脂可用汽油洗去
B. 適量攝入油脂,有利于人體吸收多種脂溶性維生素和胡蘿卜素
C. 植物油通過氫化可以制造植物奶油(人造奶油)
D. 脂肪是有機體組織里儲存能量的重要物質
查看答案和解析>>
科目: 來源: 題型:
【題目】現有A、B、C、D、E五種短周期元素,已知A、B、C、D四種元素的核內質子數之和為56,在元素周期表中的位置如圖所示,1 mol E的單質可與足量酸反應,能產生33.6 L H2(在標準狀況下);E的陽離子與A的陰離子核外電子層結構相同。
A | ||
B | C | D |
回答下列問題:
(1)寫出下列元素名稱A__________,B___________,E____________
(2)C的簡單離子結構示意圖為_____________
(3)B單質在A單質中燃燒,反應現象是__________________________________,生成物的化學式為___________
(4)A與E形成的化合物的化學式為__________,它的性質決定了它在物質的分類中應屬于__________________
(5)向D與E形成的化合物的水溶液中滴入燒堿溶液至過量,此過程中觀察到的現象是_______________________,寫出有關化學反應方程式______________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】![]() 下列物質中,既含有極性共價鍵,又含有非極性共價鍵的是______
下列物質中,既含有極性共價鍵,又含有非極性共價鍵的是______
A.![]() B.
B.![]() C.
C.![]()
![]()
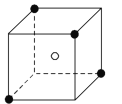
![]() 某離子晶體晶胞的結構如圖1所示,
某離子晶體晶胞的結構如圖1所示,![]() 位于立方體中心,
位于立方體中心,![]() 位于立方體頂點。該晶體的化學式為______
位于立方體頂點。該晶體的化學式為______
A.![]()
![]() C.
C.![]()
![]()
![]() 下列物質性質的變化規律與鍵能無關的是______
下列物質性質的變化規律與鍵能無關的是______
A.熱穩性:![]()
B.熔、沸點:金剛石![]() 晶體硅
晶體硅
C.熔點:![]()
D.熔、沸點:![]()
![]() 、S、Se是同一主族元素,請回答下列問題:
、S、Se是同一主族元素,請回答下列問題:
![]() 、S、Se的電負性由大到小的順序是______。
、S、Se的電負性由大到小的順序是______。
![]() 是______分子
是______分子![]() 填“極性”或“非極性”
填“極性”或“非極性”![]() ,中心原子的軌道雜化類型為______,
,中心原子的軌道雜化類型為______,![]() 分子的立體構型名稱是______。
分子的立體構型名稱是______。
![]() 的沸點高于
的沸點高于![]() 的沸點,其原因是______。
的沸點,其原因是______。
![]() 與
與![]() 分子互為等電子體的陰離子為______
分子互為等電子體的陰離子為______![]() 填化學式
填化學式![]() 。
。
![]() 已知Se原子比O原子多2個電子層,基態Se原子核外電子排布式為______,有______個未成對電子。
已知Se原子比O原子多2個電子層,基態Se原子核外電子排布式為______,有______個未成對電子。
![]() 離化合物
離化合物![]() 的晶胞如圖所示,
的晶胞如圖所示,![]() 的配位數是______;若阿伏加德羅常數值為
的配位數是______;若阿伏加德羅常數值為![]() ,晶胞參數為anm,列式計算晶體的密度
,晶胞參數為anm,列式計算晶體的密度![]() ______
______![]() 只列式,不用計算最后結果
只列式,不用計算最后結果![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】用多孔石墨電極完成下列實驗:
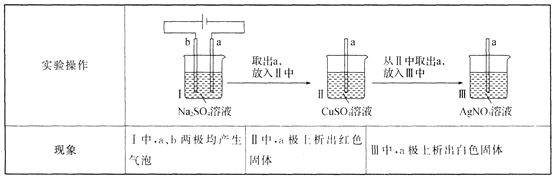
下列對實驗現象的解釋或推測不合理的是 ( )
A.I中,b極反應:2H2O-4e-=== O2↑+4 H+
B.Ⅱ中,析出紅色固體:Cu2++H2 === Cu+2H+
C.Ⅲ中,只可能發生反應:2Ag++Cu === Cu2++2Ag
D.I中,a極上既發生了化學過程,也發生了物理過程
查看答案和解析>>
科目: 來源: 題型:
【題目】一定條件下進行反應:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密閉容器中充入1.0 mol COCl2 (g),經過一段時間后達到平衡。反應過程中測得的有關數據見下表:
Cl2 (g)+CO(g)。向2.0 L恒容密閉容器中充入1.0 mol COCl2 (g),經過一段時間后達到平衡。反應過程中測得的有關數據見下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列說法正確的是 ( )
A.保持其他條件不變,升高溫度,平衡時c(Cl2) = 0.22 mol·L-1,則反應的 △H < 0
B.若在2 L恒容絕熱(與外界沒有熱量變換)密閉容器進行該反應,化學平衡常數不變
C.保持其他條件不變,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反應達到平衡前的速率:v (正) > v (逆)
D.保持其他條件不變,起始向容器中充入1.0 mol Cl2和0.8 mol CO,達到平衡時,Cl2的轉化率小于60%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com